以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ从废液中提纯并结晶出FeSO4·7H2O;
Ⅱ将FeSO4·7H2O配制成溶液;
ⅢFeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液;
Ⅳ将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeCO3固体;
Ⅴ煅烧FeCO3,得到Fe2O3固体。
已知:NH4HCO3在热水中分解。
(1)Ⅰ中,要加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是_______________。
(2)Ⅱ中,需加一定量硫酸.运用化学平衡原理简述硫酸的作用____________________。
(3)Ⅲ中,生成FeCO3的离子方程式是_________________,若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是______________________。
(4)Ⅳ中,通过检验SO42-来判断沉淀是否洗涤干净,检验SO42-的操作是_________________________________________________。
(5)已知煅烧FeCO3的化学方程式是4FeCO3+O2 2Fe2O3+4CO2,现煅烧464.0 kg的FeCO3,得到316.8 kg产品,若产品中杂质只有FeO,则该产品中Fe2O3的质量是________kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)
2Fe2O3+4CO2,现煅烧464.0 kg的FeCO3,得到316.8 kg产品,若产品中杂质只有FeO,则该产品中Fe2O3的质量是________kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)
(1)Fe+2Fe3+===3Fe2+
(2)加入硫酸,H+浓度增大,使Fe2++2H2O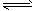 Fe(OH)2+2H+的平衡向逆反应方向移动,从而抑制Fe2+的水解
Fe(OH)2+2H+的平衡向逆反应方向移动,从而抑制Fe2+的水解
(3)Fe2++2HCO3-===FeCO3↓+CO2↑+H2O;4FeCO3+6H2O+O2===4Fe(OH)3↓+4CO2
(4)取少量洗涤后的溶液放入试管中,滴加盐酸酸化的BaCl2溶液,若无白色沉淀产生,则沉淀洗涤干净
(5)288.0
