问题
实验题
氯化亚铜(CuCl)是一种白色固体,微溶予水,不溶于硫酸、稀硝酸和醇,可溶 于氨水、浓盐酸,并生成配合物。氯化亚铜广泛应用于有机合成、染料、颜料、催化 剂等工业。生产CuCl的工业流程如下:
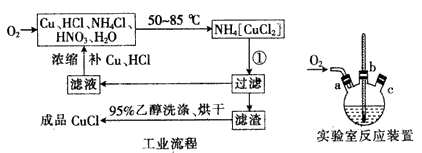
某化学兴趣小组利用如图装置在实验室制备CuCl。所用实验药品有铜丝20 g、氯化铵20 g、65%的硝酸10 mL、36%的盐酸15 mL、水。
试回答下列问题:
(1)反应①为NH4 [CuCl2]分解产生CuCl的反应,其化学方程式为____________。
(2)用95%的乙醇代替蒸馏水洗涤的主要目的是____。
(3)工业化生产时,95%的乙醇可通过________方法循环利用,而HNO3和________(填化学式)可直接循环利用。
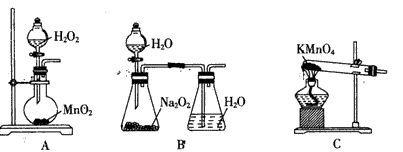
(4)实验时通入O2的速率不宜过快,为便于观察和控制产生O2的速率,宜选择下列方案中的________(填字母)。
答案
(1)NH4[CuCl2]==CuCl↓+NH4Cl
(2)既能避免CuCl溶于水而造成损耗,又能洗去晶体表面的杂质离子及水分
(3)蒸馏;NH4Cl
(4)B
