难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡
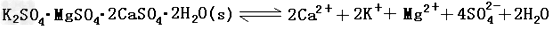
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:

(1)滤渣主要成分有_______和_______以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:__________。
(3)“除杂”环节中,先加入_______溶液,经搅拌等操作后,过滤,再加入_______溶液调滤液PH至中性。
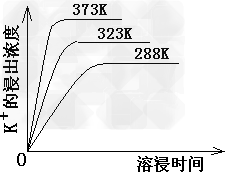
(4)不同温度下,K+的浸出浓度与溶浸时间的关系如下图,由图可得,随着温度升高,
①________________________②____________________
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:
 已知298K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,求此温度下该反应的平衡常数K(计算结果保留三位有效数字)。
已知298K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,求此温度下该反应的平衡常数K(计算结果保留三位有效数字)。
(1)Ca(OH)2;Mg(OH)2
(2)氢氧根与镁离子结合,使平衡向右移动,K+变多。
(3)K2CO3;H2SO4
(4)①在同一时间K+的浸出浓度大;②反应的速率加快,平衡时溶浸时间短。
(5)K=1.75×104
