抗氧剂亚硫酸钠可利用硫酸工业的炉气和尾气与纯碱反应来制取,生产流程如下图
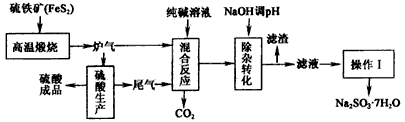
已知:①炉气、尾气中含有SO2;②混合反应中还溶解有少量Fe2O3、MgO等矿尘。
(1)煅烧1mol FeS2放出热量为853 kJ,则FeS2燃烧的热化学方程式为_________________。
(2)“混合反应”中纯碱(Na2CO3)参与反应的化学方程式为______________________(任写一个)。
(3)用NaOH“除杂”时,主要的离子方程式为______________________(任写一个)。
(4)通过“操作I”可以得到亚硫酸钠品体,写出主要操作步骤的名称:______________。
(5)硫酸生产中炉气转化反应为:2SO2(g)+O2(g)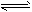 2SO3(g)。研究发现,SO3的体积分数(SO3%) 随温度(T)的变化如曲线I所示。下列判断正确的是__________。
2SO3(g)。研究发现,SO3的体积分数(SO3%) 随温度(T)的变化如曲线I所示。下列判断正确的是__________。
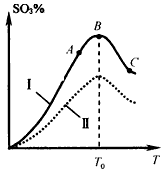
A.该反应的正反应为放热反应
B.曲线I上A、C两点反应速率的关系是:vA>vC
C.反应达到B点时,2v正(O2)=v逆(SO3)
D.已知V2O5的催化效果比Fe2O3好,若I表示用V2O5催化剂的曲线,则Ⅱ是Fe2O3作催化剂的曲线
(1)4FeS2(s)+11O2(g)=8SO2(g)+2Fe2O3(s) △H= -3412 kJ/mol
(2)SO2+Na2CO3=Na2SO3+CO2↑(或2SO2+Na2CO3+H2O=NaHSO3+CO2↑)
(3)Fe3++3OH-=Fe(OH)3↓(或Fe2++2OH-=Fe(OH)2↓或Mg2++2OH-=Mg(OH)2↓或HSO3-+OH-=SO32-+H2O)
(4)加热蒸发、冷却结晶、过滤(洗涤干燥)
(5)AC
