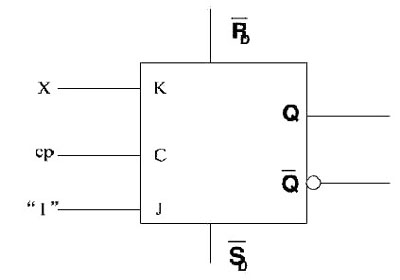
(三选一)【化学--选修2:化学与技术】
现有一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高。其主要流程如下
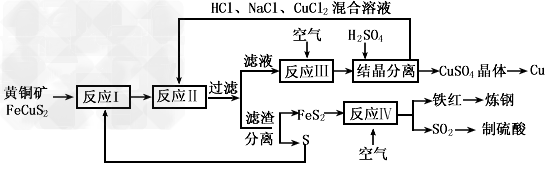
注:反应II的离子方程式为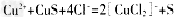
请回答:
(1) 从黄铜矿冶炼粗铜的传统丁艺是将精选后的富铜矿砂与空气在高温下煅烧,使其转变为铜、这种方法的缺点是__________________________________
(2) 反应I的产物为(填化学式) ________________________________
(3) 反应III的离子方程式为________________________________
(4) 一定温度下,在反应III所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其原因是_______________________
(5) 黄铜矿中Fe的化合价为+2,关于反应: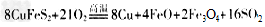
下列说法正确的是______________ (填选项字母)
A. 反应中被还原的元素只有氧
B. 反应生成的SO2直接排放会污染环境
C. SO2既是氧化产物又是还原产物
D. 当有8mol铜生成时,转移电子数目为100 NA
(6) 某硫酸厂为测定反应IV所得气体中SO2的体积分数,取280mL(已折箅成标准状况)气体样品与足量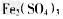 溶液完全反应后,用浓度为0.02000 mol/L 的 K2Cr2O7标准溶液滴定至终点,消耗 K2Cr2O7溶液25.00ml. 已知:
溶液完全反应后,用浓度为0.02000 mol/L 的 K2Cr2O7标准溶液滴定至终点,消耗 K2Cr2O7溶液25.00ml. 已知: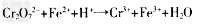 (未配平)
(未配平)
①SO2通入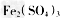 溶液,发生反应的离子方程式为________________________,
溶液,发生反应的离子方程式为________________________,
②反应IV所得气体中SO2的体积分数为________________
(1)反应有SO2生成,易造成环境污染,同时消耗大量热能
(2)CuS、FeS2
(3)4[CuCl2]- +O2+4H+=4Cu2+ +8Cl-+2H2O
(4)该温度下,硫酸铜的溶解度小于氯化铜
(5)BCD
(6)① SO2+2Fe3++2H2O=SO42-+2Fe2++4H+;② 12.00 %