(15分)氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛的应用。请回答下列问题:
(1)氨气可由N2和H2反应制取,N2(g)+3H2 (g)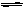 2NH3(g)反应过程的能量变化如图所示:
2NH3(g)反应过程的能量变化如图所示:
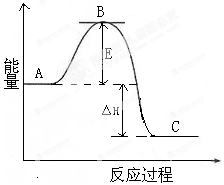
已知:1molN2分子中的化学键断裂时需要吸收942kJ的能量;1molH2分子中的化学键断裂时需要吸收436kJ的能量;形成1mol N—H键时释放390.8kJ的能量。
①图中A、C分别表示 、 ,E的大小对该反应 的反应热有无影响? 。
该反应需要用铁触媒作催化剂,加铁触媒会使图中B点升高还是降低? 理由 。
②图中△H= kJ·mol-1。
③如果反应速率ν(H2)为0.15mol· L-1·min-1,则ν(N2)= mol· L-1·min-1 ν(NH3)=
mol·L-1 ·min-1。
(2)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:N2(g)+2O2(g)=N2O4(l) △H= -19.5kJ·mol-1
N2H4(l)+O2(g)= N2(g)+2H2O(g)△H= -534.2kJ·mol-1
请写出肼和 N2O4反应的热化学反应方程式 。
(1)①1mol N2(g)和3mol H2(g)具有的总能量、2 mol NH3(g)具有的总能量(答反应物的总能量 、生成物的总能量也给分) 无、降低(各1分)
催化剂能改变反应的路径,使发生反应所需的活化能E降低(2分)
②-94.8 (2分) ③0.05 0.10 (各2分)
(2)2N2H4(l)+ N2O4(l)=3N2(g)+4H2O(g)△H= -1048.9kJ·mol-1 (3分)
(1)①根据图像可知,A表示1mol N2(g)和3mol H2(g)具有的总能量,C表示2 mol NH3(g)具有的总能量。E表示反应到活化能,对反应热是无影响的。催化剂能降低反应的活化能,加快反应速率。
②反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以反应热=942 kJ·mol-1+3×432kJ·mol-1-2×3×390.8kJ·mol-1=-94.8 kJ·mol-1。
③因为速率之比是相应的化学计量数之比,所以氮气和氨气的反应速率分别是0.15mol· L-1·min-1÷3=0.05mol· L-1·min-1、0.15mol· L-1·min-1÷3×2=0.10 mol· L-1·min-1。
(2)根据盖斯定律可知,反应①N2(g)+2O2(g)=N2O4(l)和反应②N2H4(l)+O2(g)= N2(g)+2H2O(g)合并即可,即②×2-①得到2N2H4(l)+ N2O4(l)=3N2(g)+4H2O(g),所以反应热=-534.2kJ·mol-1×2+19.5kJ·mol-1=-1048.9kJ·mol-1。
