(14分)
某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:
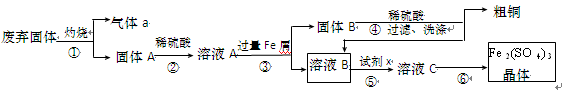
(1)除酒精灯和铁架台或三脚架外,①中所需的容器和夹持仪器分别为 、
,①和⑥中都用到的仪器为 ;
(2)试剂x的化学式为 ;x与溶液B反应的离子方程式为 ;
(3)某同学取少量的溶液B向其中加入过量的某种强氧化剂,再滴加KSCN溶液,发现溶液变红色,放置一段时间后,溶液褪色,该同学猜测溶液褪色的原因是溶液中的SCN-被过量的氧化剂氧化所致。
现给出以下试剂:1.0 mol·L-1 硫酸、1.0 mol·L-1 NaOH溶液、0.1 mol·L-1 Fe2(SO4)3溶液、20%KSCN溶液、蒸馏水。请你设计合理实验验证乙同学的猜测是否合理。简要说明实验步骤和现象 ;
(4)某同学用实验制得的Fe2(SO4)3晶体配制0.1 mol·L-1的Fe2(SO4)3溶液,在称量出Fe2(SO4)3晶体后,溶解该晶体的具体操作为 。
(1)坩埚、坩埚钳(2分),玻璃棒(2分)
(2)H2O2;2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O(每空2分)
(3)取少量褪色后的溶液于试管中(1分),逐滴加入过量的20%KSCN溶液(1分),如溶液变红色(1分),说明乙同学的猜测是合理的,如不变红色,说明猜测不合理。(或滴加过量的0.1 mol·L-1 Fe2(SO4)3溶液,如溶液不变红色,说明合理,若变红色,说明猜测不合理)
(4)将称量的晶体置于烧杯中(1分),加入适量的稀硫酸(1分)和蒸馏水,用玻璃棒搅拌(1分)
本题重点在流程的分析,第一步,灼烧,金属硫化物,在灼烧过程中转化为金属氧化物和SO2,第二步,稀硫酸溶解,氧化物转化为Fe3+、Cu2+,第三步,加入铁后,置换出Cu和还原Fe3+成Fe2+,故固体B为Fe和Cu的混合物,溶液B为FeSO4,第四步,加入稀硫酸,Fe溶解,得到粗铜,第五、六步将FeSO4得到Fe2(SO4)3晶体,要经历氧化,蒸发浓缩,冷却结晶等步骤。(3)问中探究褪色的原因,关键在与Fe3+、SCN-是否还存在,可以检验Fe3+或SCN-。
