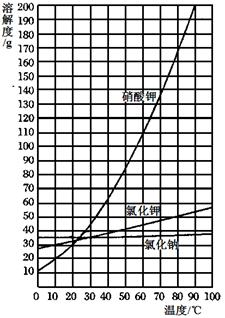
(9分)以下是某化学兴趣小组实施的从硝酸钾、氯化钠、氯化钾的混合物(其中氯化钠和氯化钾的质量和小于总质量的3%)中分离出硝酸钾的实验步骤:(三种物质的溶解度曲线见右图)
Ⅰ.用托盘天平称得样品的总质量为87.5g;
Ⅱ.配制成80℃左右的饱和溶液;
Ⅲ.将热饱和溶液冷却至室温(20℃)后进行过滤,并用少量水洗涤2—3次;
Ⅳ.取出过滤器中的固体,干燥后分装。
请回答以下问题:
(1)用天平称取87.5g样品时,砝码应放在天平的 ▲ 盘;
(2)某同学发现,无论将称量物还是砝码放置于托盘中时,天平均不发生偏转,原因是 ▲
A.天平未放置于水平桌面上
B.天平没有调零
C.托盘下的垫圈未取下
D.游码未归零
(3)将这些样品制成80℃左右的热饱和溶液,约需 ▲ 水(填序号);
A.12.5mL B.50 mL C.100 mL D.112.5mL
(4)该实验中,玻璃棒除了用于搅拌和引流外,还用于 ▲ ;
(5)步骤Ⅲ中,只能用少量水洗涤固体的原因是 ▲ ;
(6)过滤并洗涤后,氯化钾存在于 ▲ 中;
(7)如果实验中热饱和溶液未完全冷却至室温就进行过滤将会影响晶体的产量,理由是 ▲ 。
(9分)
(1)右(1分) (2)C(2分) (3)B(2分)
(4)转移固体(1分)
(5)因晶体易溶于水,洗涤用水越少,晶体质量损失越小(1分)
(6)滤液(1分)
(7)根据溶解度曲线可知,该硝酸钾饱和溶液在较高温度下结晶,析出的晶体质量较少 (1分)
分析:(1)(2)根据托盘天平的正确使用方法分析即可.
(3)根据表格中硝酸钾在80℃的溶解度去计算.
(4)根据实验操作中玻璃棒的各种用途去分析.
(5)洗涤可溶性物质时应该用少量水去洗涤.
(6)根据表格数据中氯化钠、氯化钾的溶解度随温度的变化情况去分析.
(7)个布局表格数据中硝酸钾的溶解度随温度变化曲线分析.
解答:解:(1)用托盘天平称量物体时应遵循左物右码的原则.故答案为:右
(2)天平在使用前应先把托盘下的垫圈取下,不然会出现无论将称量物还是砝码放置于托盘中时,天平均不发生偏转.
故选C
(3)从表格数据中得到80℃时硝酸钾的溶解度大约是170g,所以溶解大约87.5g的硝酸钾用水量≈ ≈51mL.故选B
≈51mL.故选B
(4)当过滤结束后,含需要把滤纸上的晶体取下来放到其它容器中,此时就要用到玻璃棒,故答案为:转移固体.
(5)过滤结束后还需要把晶体表面的离子洗去,但洗涤时不能用水太多,因为此晶体是可溶性的,若用水太多,会损失的晶体较多,故答案为;因为晶体易溶于水,洗涤晶体时用水越少,晶体损失越少.
(6)因为氯化钾、氯化钠的溶解度随温度变化不大,而硝酸钾的溶解度随温度变化很大,当把热的饱和溶液冷却到室温后,绝大多数的硝酸钾会从溶液中析出来,而氯化钠、氯化钾仍然留在溶液中,故答案为:滤液.
(7)如果实验根据溶解度曲线可知,若硝酸钾饱和溶液在较高温度下结晶,析出的晶体质量较少.影响硝酸钾的析出量.故答案为:根据溶解度曲线可知,若硝酸钾饱和溶液在较高温度下结晶,析出的晶体质量较少.