(8分)碘化钠是实验室中常用的分析试剂,工业上用铁屑还原法制备NaI的流程如下图:
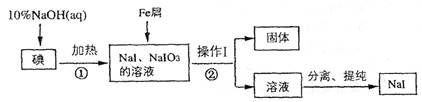
请回答下列问题:
(1) 判断反应①中碘是否反应完全的方法是_____________________
(2) 操作I的名称是_____________________;
(3) 反应①的离子方程式为_____________________
(4) 反应②中NaIO3被Fe单质还原为NaI,同时生成Fe(OH)3,该反应的化学方程式是______;
在该反应中若有99 g NaIO3被还原,则转移电子的物质的量为_______mol
(8分)(1)取少量反应后的溶液于试管中,滴入几滴淀粉溶液,若溶液未变蓝,则证明碘已反应完全;反之,碘未反应完全。(1分)(或取少量反应后的溶液于试管中,滴入几滴CCl4,振荡、静置,若下层液体呈无色,证明碘已反应完全;若下层液体呈紫红色,证明碘未反应完全。)
(2)过滤(1分) (3)3I2 + 6OH-=5I-+ IO3-+ 3H2O (2分)
(4)2Fe+ NaIO3+ 3H2O=2Fe(OH)3↓+NaI (2分) 3(2分)
本题考查工业流程有关知识。(1)单质碘遇淀粉变蓝,因此可用淀粉溶液检验。也可采用萃取的方法,将碘单质萃取出来。看萃取剂中的颜色。即取少量反应后的溶液于试管中,滴入几滴淀粉溶液,若溶液未变蓝,则证明碘已反应完全;反之,碘未反应完全(或取少量反应后的溶液于试管中,滴入几滴CCl4,振荡、静置,若下层液体呈无色,证明碘已反应完全;若下层液体呈紫红色,证明碘未反应完全)。(2)从流程图看,操作I的名称后面得到的是固体和溶液,故操作I的名称是过滤。(3)从反应前后可以看出,反应物为NaOH和I2,产物为NaI和NaIO3,故反应的离子方程式为3I2 + 6OH-=5I-+ IO3-+ 3H2O;(4)NaIO3被Fe单质还原为NaI,同时生成Fe(OH)3,该反应的化学方程式是2Fe+ NaIO3+ 3H2O=2Fe(OH)3↓+NaI,从方程式前后化合价的升降来看,在该反应中若有99 g NaIO3(即0.5mol)被还原为NaI(得到6mol电子),则转移电子的物质的量为3mol
