(1)2SO2(g)+O2(g)  2SO3(g) 反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= –99kJ/mol。请回答下列问题:
2SO3(g) 反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= –99kJ/mol。请回答下列问题:
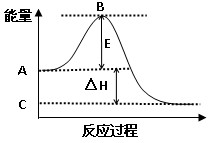
①图中A点表示 ; C点表示 ;E的大小对该反应的反应热 ;(填“有”或“无”)影响。
②图中△H= kJ/mol。
(2)25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,则氢气的燃烧热的化学方程式为 。
(3)①C(s) + O2(g) = CO2(g);ΔH = –393.5kJ/mol
②CO(g) + 1/2 O2(g) = CO2(g);ΔH = –283kJ/mol
根据上述信息,写出C转化为CO的热化学方程式为 。
(10分)
(1)①反应物的总能量; 生成物的总能量; 无; –198 。(每空1分,共4分)
(2)(3分)H2(g) + 1/2O2 (g)= H2O(l) (2分) △H=–285.8kJ/mol (1分)
(3)(3分)C(s) +1/2O2 (g) =" CO(g)" (2分) △H=–110.5kJ/mol (1分)
(1)①根据图像可知,A点表示反应物的总能量,而C点表示生成物的总能量。由于E表示的是活化能,所以E不能影响反应热的大小。
②由于1mol SO2(g)氧化为1mol SO3(g)的ΔH= –99kJ/mol,而图中表示的是2molSO2反应的情况,所以此时的反应热△H=-198kJ/mol。
(2)由于燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以根据题意可知,该反应的热化学方程式是H2(g) + 1/2O2 (g)= H2O(l) △H=–285.8kJ/mol。
(3)考查盖斯定律的有关应用。根据盖斯定律可知,①-②即得到C(s) +1/2O2 (g) = CO(g),所以该反应的反应热△H=–393.5kJ/mol+283kJ/mol=–285.8kJ/mol。