问题
填空题
纯碱(Na2CO3)在工业生产和生活中有重要应用,其实验室制法和工业制法如下:
【实验室制备纯碱】
①将饱和NaCl溶液倒入烧杯中加热,控制温度为30-35℃
②搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟
③静置、过滤得NaHCO3晶体
④用少量蒸馏水洗涤、抽干
⑤将所得固体转入蒸发皿中灼烧得Na2CO3固体
问题:
(1)反应将温度需控制在30-35℃,通常采取的加热方法为_________________ ;控制该温度的原因是
__________________;
(2)静置后只析出NaHCO3晶体的原因是____________________。
【工业制备纯碱】
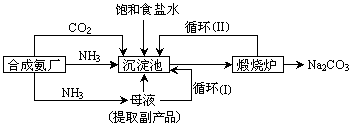
(3)沉淀池中反应的离子方程式为_________________________;
(4)循环(I)、 循环(Ⅱ)中物质的化学式分别为_____________________。两种制备纯碱的方法中,共同涉及的化学反应方程式为_________________________。
答案
(1)水浴加热;防止NH4HCO3分解而影响NaHCO3晶体的生成
(2)碳酸氢钠溶解度最小
(3)Na++NH3+H2O+CO2==NaHCO3↓+NH4+
(4)NaCl、CO2;2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
