【三选一----化学与技术】
纯碱是一种重要的化工原料,目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:___________;
(2)写出“联合制碱法”有关反应的化学方程式:___________ 、____________ ;
(3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同? _____________;
(4)“联合制碱法”是对“氨碱法”的改进,其相对优点有___________ (填序号)
A.提高了原料的原子利用率 B.降低了生产成本 C.减少了环境污染
D.减轻了对设备的腐蚀
(5)绿色化学的主要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应,列出计算原子利用率的表达式:原子利用率(%)= ____________ 。
(6)产品纯碱中常含有碳酸氢钠,如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,已知所取产品的质量为m1g,加热后所剩固体的质量为m2g,则纯碱中碳酸氢钠的质量分数可表示为 _____________。
(1)2NH4Cl+Ca(OH)2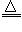 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O
(2)NH3+CO2+H2O+NaCl(饱和)===NaHCO3↓+NH4Cl ;2NaHCO3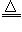 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(3)“氨碱法”的CO2来源于石灰石煅烧,“联合制碱法”的CO2来源于合成氨工业的废气。
(4)ABC
(5)“联合制碱法”原子利用率的表达式:

(6)w(NaHCO3)=
