根据要求完成下列问题:
(1)有以下物质:①SO2Cl2 ②C2H6 ③CS2 ④HClO ⑤H2O2
含有非极性键的非极性分子是___________;
以极性键相结合,具有直线型结构的非极性分子是___________;
以极性键相结合,具有四面体形结构的极性分子是___________;
以极性键相结合,具有V型结构的极性分子是___________;
(2)在S8、SiC、NaCl、C2H5OH中,能形成分子晶体的化合物是 ,含有氢键的晶体的化学式是 ,属于原子晶体的是 ,
四种物质形成的晶体熔点由高到低的顺序是 > > > 。
下图立方体中心的“o”表示SiC晶体中的一个硅原子,请在立方体的顶点用“●”表示出与之紧邻的碳原子。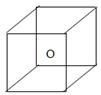
(每空各1分)(1)②;③;①;④
(2)C2H5OH; C2H5OH; SiC; SiC>NaCl>S8>C2H5OH

题目分析:在化合物分子中,不同种原子形成的共价键,由于两个原子吸引电子的能力不同,共用电子对必然偏极性键说明向吸引电子能力较强的原子一方,因而吸引电子能力较弱的原子一方相对的显正电性。这样的共价键叫做极性共价键,简称极性键。
分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子,以极性键结合的双原子一定为极性分子,极性键结合的多原子分子视结构情况而定。
在单质分子中,同种原子形成共价键,两个原子吸引电子的能力相同,共用电子对不偏向任何一个原子,因此成键的原子都不显电性。这样的共价键叫做非极性共价键,简称非极性键。
非极性分子是指原子间以共价键结合,分子里电荷分布均匀,正负电荷中心重合的分子。
分子晶体是指分子间通过分子间作用力(包括范德华力和氢键)构成的晶体。
相邻原子之间通过强烈的共价键结合而成的空间网状结构的晶体叫做原子晶体。
点评:本题考查的知识比较综合,有比较性,题目难度适中,考查学生对基础知识的掌握程度,平时多积累这方面的知识。
