已知下列热化学方程式:(10分)
①H2(g)+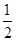 O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
②H2(g)+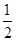 O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
③C(s)+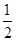 O2(g)=CO(g) ΔH=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH=-110.5 kJ·mol-1
④C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1,
回答下列问题:
(1)上述反应中属于放热反应的是____________。
(2)H2的燃烧热为____________;C的燃烧热为____________。
(3)燃烧10 g H2生成液态水,放出的热量为____________。
(4)写出CO燃烧的热化学方程式__________________________________。
(每空2分,共10分)
(1)①②③④
(2)285.8 kJ·mol-1 393.5 kJ·mol-1
(3)1429kJ
(4)CO(g)+ 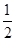 O2(g)=CO2(g) ΔH=-283.5 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.5 kJ·mol-1
题目分析:放热反应的ΔH<0故①②③④都属于放热反应;H2的燃烧热反应方程式是①式为285.8 kJ·mol-1;C的燃烧热反应方程式是④式为393.5 kJ·mol-1
;燃烧10 g H2生成液态水,放出的热量为1429kJ
;CO燃烧的热化学方程式由盖斯定律得④—③即CO(g)+ 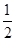 O2(g)=CO2(g) ΔH=-283.5 kJ·mol-1。
O2(g)=CO2(g) ΔH=-283.5 kJ·mol-1。
点评:在25摄氏度,101 kPa时,1 mol可燃物完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热。
定义要点:
①规定在101 kPa压强,常温25度下测出热量,因为压强和温度不定,反应热数值不相同.
②规定可燃物物质的量为1 mol.
③规定可燃物完全燃烧生成稳定化合物所放出的热量为标准.
注意点:
燃烧热是以1 mol可燃物作为标准来进行测定的,因此在计算燃烧热时,热化学方程式里其他物质的化学计量数常出现分数:如H2(g)+ 1/2O2(g)====H2O(l);ΔH=-285.8 kJ·mol-1。
点拨
(1)书写燃烧反应的热化学方程式时可燃物一定是1 mol,即可燃物的计量系数一定是1,其他物质的计量系数可以用分数或小数表示(建议用分数)。
(2)单质或化合物必须是完全燃烧,如反应物中C→CO2,H2→H2O(液),S→SO2(气)等。
(3)这里的燃烧概念是广义的,但通常是指可燃物与O2反应的燃烧热。
