(Ⅰ)在容积不变的密闭容器中,分别充入1.0mol N2和3.0molH2,任其发生反应:
N2(g)+3H2(g)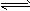 2NH3(g),分别在不同时测定NH3的含量,然后绘制出下图
2NH3(g),分别在不同时测定NH3的含量,然后绘制出下图
试回答下列问题:
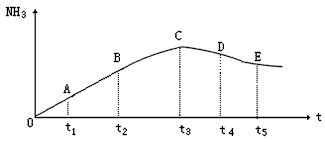
(1)A、C段的曲线是增函数,C、E段曲线是减函数,试从反应速率和化学平衡的角度说明理由:
_____________________
(2)此可逆反应的正反应是________反应(填“放热”或“吸热”),在实际生产上,合成氨反应一般选择在500℃左右的温度下进行,试从化学平衡移动原理和综合因素等角度分析“选择在500℃左右下进行”的原因:____________________
(Ⅱ)利用天然气合成NH3的工艺流程如下
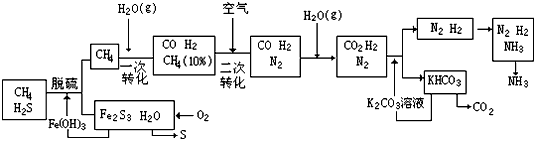
依据上述流程,完成下列填空:
(3)天然气脱硫时的化学反应方程式是___________________
(4)nmol甲烷经一次转化后产生CO 0.9nmol,则产生H2_________摩(用含n的代表式表示)。
(5)上述过程中包含了三个循环,一是Fe(OH)3循环,二是K2CO3循环,请在上述流程图中标出第三处循环(指出循环方向和循环物质)。
(1)A、C段为增函数,原因是开始充入的物质是N2和H2,未达到化学平衡,故φ(NH3)不断增大,C点达到平衡后,随着温度升高平衡向逆反应方向移动,φ(NH3)的含量减少,故CE段为减函数
(2)放热;由于合成氨的反应是放热反应,根据化学平衡移动原理,较低温度下有利于氨的生成,但温度过低,反应速率很小,单位时间的产量低,这在工业生产上是很不经济的,而且500℃时此反应的催化剂的活性最大
(3)3H2S +2Fe(OH)3==Fe2S3+6H2O
(4)2.7nmol
(5)