在一个密闭容器中,发生下列反应:C(s)+H2O(g) 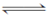 CO(g)+H2(g) ΔH>0,达到平衡后,试回答下列问题
CO(g)+H2(g) ΔH>0,达到平衡后,试回答下列问题
(1)上述正向反应是: 反应(填:放热、吸热)。
(2)该反应的化学平衡常数表达式为K= 。
(3)恒温恒容通人H2O(g),原化学平衡向 反应方向移动(填“正移”、“逆移”“不移”下同)c(CO)____(填“增大”、“减小”或“不变” 下同)。
(4)减小密闭容器的容积,保持温度不变,原化学平衡向 反应方向移动,v(正) 。
(5)某温度下上述反应平衡时,恒容、降低温度,原化学平衡向 反应方向移动,容器内混合气体的压强 。
(1) 吸热 。 (2)K= Cco·CH2/CH2O 。
(3) 正 , 增大 (4) 逆 , 增大 。(5) 逆 , 减小
题目分析:(1)根据反应的热化学方程式可知,上述正向反应是吸热反应。
(2)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则根据方程式可知,平衡常数K=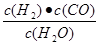 .
.
(3)恒温恒容通人H2O(g),相当于是增大反应物浓度,则原化学平衡向正反应方向移动,c(CO)增大。
(4)减小密闭容器的容积,保持温度不变,相当于是增大压强,原化学平衡向逆反应方向移动,v(正)增大。
(5)某温度下上述反应平衡时,恒容、降低温度,原化学平衡向逆反应方向移动,容器内混合气体的压强减小。
点评:该题是高考中的常见题型,属于基础性试题的考查。试题基础性强,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理能力和发散思维能力,提高学生灵活运用基础性知识解决实际问题的能力。
