(16分)氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是________。
A.煤的形成
B.原电池工作
C.简单机械织布
D.我国古代烧制陶器(2)水是人体的重要组成部分,是人体中含量最多的一种物质。“四种基本反应类型与氧化还原反应的关系”可用下图表示。
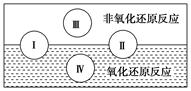
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:_________________________,其中水为________剂。
(3)氯化铵常用于焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:
________CuO+________NH4Cl ________Cu+______CuCl2+______ N2↑+______H2O。
________Cu+______CuCl2+______ N2↑+______H2O。
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是________(填元素名称),氧化剂是________(填化学式)。
③反应中若产生0.2 mol的气体,则有________ mol的电子转移。
(1)C (2分)(2)C+H2O(g) CO+H2 (3分)氧化(1分)
CO+H2 (3分)氧化(1分)
(3)①4CuO+2NH4Cl 3Cu+CuCl2+N2↑+4H2O(各1分)
3Cu+CuCl2+N2↑+4H2O(各1分)
②氮 (1分)CuO (1分)③1.2(2分)
(1)凡是有元素化合价升降的反应都是氧化还原反应,所以选项ABD中都涉及氧化还原反应,选项C是物理变化,一定不是氧化还原反应,答案选C。
(2)Ⅳ是置换反应,因此符号条件的可以是C+H2O(g) CO+H2,在该反应中氢元素的化合价降低,所以水是氧化剂。
CO+H2,在该反应中氢元素的化合价降低,所以水是氧化剂。
(3)①氧化铜具有氧化性,能氧化氯化铵。在反应中铜的化合价从+2价降低到0价,得到2个电子。氮元素的化合价从-3价升高到0价,失去3个电子,所以氧化剂和还原剂的物质的量之比是3︰2,因此反应的方程式为4CuO+2NH4Cl 3Cu+CuCl2+N2↑+4H2O。
3Cu+CuCl2+N2↑+4H2O。
②氮元素的化合价升高,所以被氧化的元素是氮;铜元素的化合价降低,因此氧化铜是氧化剂。
③根据方程式可知,每生成1mol氮气,转移6mol电子,所以若产生0.2 mol的气体,则有1.2mol气体生成。
