右图是固体硝酸钾的溶解度曲线,根据要求回答下列问题:
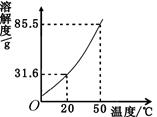
(1)硝酸钾溶液中的溶剂是 。
(2)从右图溶解度曲线可以得到的信息是_____(写一条即可)
(3)欲将一瓶接近饱和的硝酸钾溶液变成饱和溶液,可采取的方法是 (写出一种即可)
(4)在20℃和50℃两种条件下,某同学对硝酸钾固体进行了如下图所示的实验,得到相应的溶液① ~ ⑤,其中说法正确的是 。
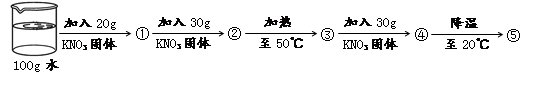
A.④中溶质的质量分数最大
B.②⑤中溶质的质量分数相等
C.①③④中没有固体存在
D.②④⑤的溶液为饱和溶液
(1)水 (2)硝酸钾溶解度随温度的升高而增大
(3)降低温度至固体析出(或加入硝酸钾固体等)(4)ABC(错答、漏答均不得分)
题目分析:根据硝酸钾的溶解度曲线分析判断。
(1)如果不说明溶剂,溶液的溶剂都看作是水,则可知硝酸钾溶液中的溶剂是水。
(2)根据硝酸钾的溶解度曲线可知,硝酸钾的溶解度随温度的升高而增大;或20℃时,硝酸钾的溶解度为31.6g,或50℃时,硝酸钾的溶解度为85.5g。
(3)由图可知,硝酸钾的溶解度随温度的升高而增大,故将一瓶不饱和的硝酸钾溶液变成饱和溶液,可采取的方法有:加入硝酸钾固体至不能溶解,或蒸发溶剂直至有固体析出,或降低温度至有固体析出。
(4)由于20℃时,硝酸钾的溶解度为31.6g,因此在20℃时,100g水中加入20g硝酸钾固体,所得到的溶液①是不饱和溶液;再加入30g硝酸钾固体,相当于在20℃时,100g水中加入了50g硝酸钾固体,则所得到的溶液②已达到饱和,且有50g-31.6g=18.4g固体不溶解;由于50℃时,硝酸钾的溶解度为85.5g,因此将溶液②升温至50℃时,溶液就会变成不饱和溶液,即溶液③是不饱和溶液;再加入30g硝酸钾固体,相当于在50℃时,100g水中加入了80g硝酸钾固体,仍小于85.5g,则所得到的溶液④也是不饱和溶液;但降温至20℃时,由于溶解度变小为31.6g,故溶液中就会有晶体析出,且为80g-31.6g=48.4g,即溶液⑤是饱和溶液。
A.由于溶剂都是100g,而④中溶解溶质最多(100g),故溶质的质量分数最大,正确;
B.由于②⑤同为硝酸钾在20℃时的饱和溶液,故其中溶质的质量分数相等,正确;
C.由于①③④都是不饱和溶液,故其中没有固体存在,正确;
D.②⑤的溶液为饱和溶液,④是不饱和溶液,错误。故选ABC
点评:本题难度不是很大,主要考查了固体溶解度曲线所表示的意义及根据溶解度曲线来解决相应的问题,解题的关键是要熟记和理解固体溶解度曲线及其应用,并能灵活运用于实际问题的解答。
