(9分)亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖的漂白剂和杀菌。以下是用过氧化氢法生产亚氯酸钠的工艺流程图:
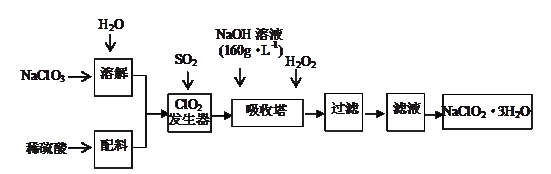
已知:NaOH溶液(160g·L-1)是指每升溶液中含溶质160 g。
试回答下列问题:
(1)该NaOH溶液的物质的量浓度为 。
(2)在吸收塔中,ClO2、NaOH与H2O2反应生成NaClO2和O2,则该反应中还原剂与氧化剂的物质的量之比为 。
(3)NaClO2较稳定,但其固体在加热时或敲击时会立即发生爆炸,其爆炸后的产物可能是
(填字母)
A.NaCl、Cl2
B.NaCl、NaClO
C.NaClO3、NaClO4
D.NaCl、NaClO3(4)NaClO3与SO2反应生成ClO2,写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目: 。
(1)4mol/L ------2分 (2)1:2-------2分 (3)D---------2分
(4)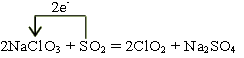 ----------------3分
----------------3分
(1)NaOH溶液是160g·L-1,所以物质的量浓度是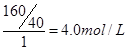 。
。
(2)氯元素的化合价从+4价降低到+3价,氧元素的化合价从-1价升高到0价,所以氧化剂ClO2和还原剂H2O2的物质的量之比是2︰1。
(3)根据题意可知,氯元素的化合价既升高,还降低,所以选项D正确。
(4)氯元素的化合价从+5价降低到+4价,得到1个电子,作氧化剂。S的化合价从+4价升高到+6价,失去2个电子,作还原剂,所以氧化剂和还原剂的物质的量之比是2︰1,因此方程式为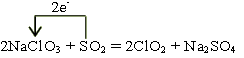 。
。
