问题
选择题
如图所示,ΔH1=-393.5 kJ·mol-1,ΔH2=-395.4 kJ·mol-1,下列说法或表示式正确的是( )
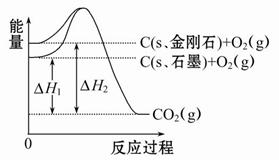
A.C(s、石墨)=C(s、金刚石)ΔH=+1.9 kJ·mol-1
B.石墨和金刚石的转化是物理变化
C.金刚石的稳定性强于石墨
D.1 mol石墨的能量比1 mol金刚石的总能量大
答案
答案:A
根据图中所示可知,C(s、金刚石)+O2(g)=CO2(g) ΔH =ΔH2=-395.4 kJ·mol-1,C(s、石墨)+O2(g)=CO2(g) ΔH=ΔH1=
-393.5 kJ·mol-1,所以石墨转化为金刚石的热化学方程式为C(s、石墨)C(s、金刚石)ΔH=+1.9 kJ·mol-1,A对;石墨转化为金刚石,因为有新物质生成,所以为化学反应,B错;因为金刚石的能量比石墨的能量高,所以石墨更稳定,C错;C(s、石墨) C(s、金刚石)ΔH= +1.9 kJ·mol-1,说明石墨的能量比金刚石的能量小,D错。
