Ⅰ(4分)右图为A、B、C三种物质的溶解度曲线,据图回答:
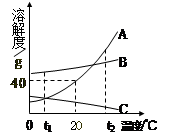
⑴ t2℃时,A、B、C三种物质的溶解度由大到小顺序是 。
⑵ 将t2℃时三种物质等质量的饱和溶液分别降温到0℃时,析出溶质最多的是 。
⑶ 20℃时,将30g A物质放入50g水中,充分搅拌,所得溶液的质量是 g。
⑷ 若将t1℃三种物质的饱和溶液分别升温到t2℃时,则三种溶液中溶质的质量分数由大到小的顺序是 。
Ⅱ(5分)元素周期律和周期表是学习化学的重要工具。下表是元素周期表的部分信息。
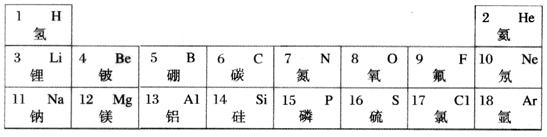
(1)列出的18种元素中,有 种属于金属元素。
(2)从原子结构角度看,同一周期元素的原子具有相同的 数。某粒子结构
示意图为 ,该粒子所属元素位于周期表的第 周期。
,该粒子所属元素位于周期表的第 周期。
(3)观察硫原子结构示意图,在下图中填空: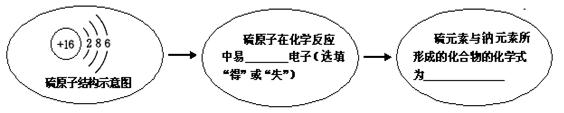
Ⅰ(1)A B C (或A>B>C) (2) A (3)70 (4)B>A>C
Ⅱ(1)5 (2)电子层 三 (3)得 Na2S
题目分析:Ⅰ根据固体物质的溶解度曲线分析。
(1)根据溶解度曲线可以比较相同温度时(或一定温度范围内)不同物质溶解度的大小,t2℃时,A、B、C三种物质的溶解度曲线的位置关系为:物质A的溶解度曲线位于最上方,而物质C的溶解度曲线位于最下方,故可判断此时三种物质的溶解度大小顺序为A>B>C。
(2)由溶解度曲线图可知,A、B两物质的溶解度都随温度的升高而增大,而C物质的溶解度是随温度的升高而减小的,故将t2℃时三种物质等质量的饱和溶液分别降温到0℃时,A、B因溶解度变小而有溶质析出,且从t2℃降到0℃时,A物质的溶解度变化更大,故等质量的饱和溶液中A物质析出的溶质更多,而C物质会因溶解度变大,而变为不饱和溶液。故选A
(3)根据溶解度曲线可知,20℃时,A物质的溶解度是40g,即该温度下,每100g水中最多溶解40gA物质,所以20℃时,将30g A物质放入50g水中,充分搅拌,只能溶解20g,则所得溶液的质量是70g。
(4)由溶解度曲线图可知,t1℃时,三种物质的溶解度大小顺序为B>A=C,则根据饱和溶液的溶质质量分数= ×100﹪可知,t1℃三种物质的饱和溶液中的溶质质量分数大小为B>A=C;由于A、B两物质的溶解度都随温度的升高而增大,而C物质的溶解度是随温度的升高而减小的,故若将t1℃三种物质的饱和溶液分别升温到t2℃时,A、B均变为不饱和溶液,但溶质质量分数不变,而C因溶解度变小而有溶质析出,故溶质质量分数变小,故此时三种溶液中溶质的质量分数由大到小的顺序是B>A>C。
×100﹪可知,t1℃三种物质的饱和溶液中的溶质质量分数大小为B>A=C;由于A、B两物质的溶解度都随温度的升高而增大,而C物质的溶解度是随温度的升高而减小的,故若将t1℃三种物质的饱和溶液分别升温到t2℃时,A、B均变为不饱和溶液,但溶质质量分数不变,而C因溶解度变小而有溶质析出,故溶质质量分数变小,故此时三种溶液中溶质的质量分数由大到小的顺序是B>A>C。
Ⅱ根据元素周期表的特点分析。
(1)根据化学元素的汉字名称的偏旁可辨别元素的种类,金属元素名称一般有“金”字旁,由此可知,所列出的18种元素中,有锂,铍、钠,镁,铝 5种金属元素。
(2)根据元素周期律可知,同一周期的元素的原子具有相同的电子层数;在原子中,核内质子数=核外电子数,由该粒子的结构示意图可知,该粒子的核内质子数为12,则其核外电子数也应为12,由此可知,该粒子的原子的核外还有1层电子层,即共有3层,故属于第三周期。
(3)根据硫原子的结构示意图可知,硫原子的核外的最外层电子数为6,大于4,故在化学反应中容易得到2个电子,而达到相对稳定结构,形成的硫离子为S2-;而钠原子的核外的最外层电子数为1,小于4,故在化学反应中容易失去1个电子,而达到相对稳定结构,形成的钠离子为Na+,故钠元素与硫元素形成的化合物的化学式为Na2S。
点评:本题主要考查了固体溶解度曲线所表示的意义,以及对元素周期律的认识与微粒结构示意图的理解等多个知识,注重培养学生的分析问题、解决问题的能力,解题的关键是要熟记和理解固体溶解度曲线及其应用,以及元素周期表的特点及其应用。
