问题
选择题
已知:
S(s)+O2(g) SO2(g) ΔH=-297.16 kJ·mol-1,
SO2(g) ΔH=-297.16 kJ·mol-1,
2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1。
2SO3(g) ΔH=-196.6 kJ·mol-1。
下列说法正确的是 ( )
A.1 mol SO2(g)的能量总和大于1 mol S(s)和1 mol O2(g)的能量总和
B.将2 mol SO2(g)与1 mol O2(g)在一定条件下充分反应,放出196.6 kJ的热量
C.S(g)+O2(g)=SO2(g) ΔH=-Q,Q值小于297.16 kJ
D.当1 mol S(s)完全转化为SO3(g)时(假设无热量损失),放出395.46 kJ的热量
答案
答案:D
放热反应生成物的能量总和小于反应物的能量总和,A项错误;B项忽视了可逆反应不能进行彻底,错误;气态硫燃烧放出的热量比液态硫燃烧放出的热量多,C项错误;根据盖斯定律,第一个方程式+第二个方程式× 可得S(s)+
可得S(s)+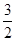 O2(g)=SO3(g) ΔH=-395.46 kJ·mol-1,D项正确
O2(g)=SO3(g) ΔH=-395.46 kJ·mol-1,D项正确
