人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
(1)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下:
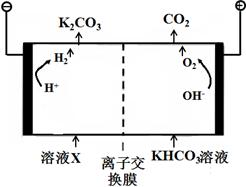
在阳极区发生的反应包括 和H ++ HCO3-=H2O+CO2↑。
简述CO32-在阴极区再生的原理 。
(2)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。
已知:25 ℃,101 KPa下:
H2(g)+1/2 O2(g)=H2O(g) Δ H1=" -242" kJ/mol
CH3OH(g)+3/2 O2(g)=CO2 (g)+2 H2O(g) Δ H2=" -676" kJ/mol
写出CO2和H2生成气态甲醇等产物的热化学方程式 。
下面表示合成甲醇的反应的能量变化示意图,其中正确的是 (填字母序号)。
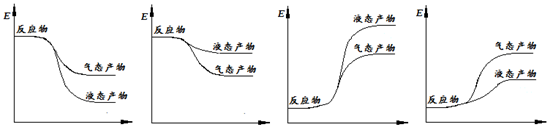
a b c d
(3)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置。已知某种甲醇
微生物燃料电池中,电解质溶液为酸性,示意图如下:
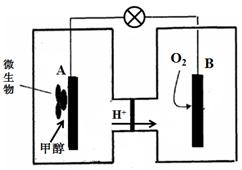
该电池外电路电子的流动方向为 (填写“从A到B”或“从B到A”)。
工作结束后,B电极室溶液的pH与工作前相比将 (填写“增大”、“减小”或“不变”,溶液体积变化忽略不计)。
A电极附近甲醇发生的电极反应式为 。
(1)①4OH--4e-=2H2O+O2↑(2分)
②答案1:HCO3 –存在电离平衡:HCO3 – H++CO32- (1分),阴极H+放电浓度减 * * 衡右移(1分)CO32-再生
H++CO32- (1分),阴极H+放电浓度减 * * 衡右移(1分)CO32-再生
答案2:阴极H+放电OH-浓度增大(1分),OH-与HCO3 –反应生成CO32-(1分)CO32-再生
(2)①CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H="-50" kJ/mol(2分) ② a(2分)
(3)①从A到B(1分) ②不变(1分)
③CH3OH+H2O - 6e-=6H++ CO2↑(2分)
题目分析:(1)①阳极上H2O电离出的OH‾失电子,电极方程式为:4OH - - 4e-=2H2O+O2↑
②阴极上H+放电发生得电子反应:2H++2e‾=H2↑,HCO3‾存在电离平衡:HCO3‾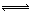 CO32‾+H+,H+浓度减小,使HCO3‾电离平衡向右移动,CO32‾浓度增大而再生。
CO32‾+H+,H+浓度减小,使HCO3‾电离平衡向右移动,CO32‾浓度增大而再生。
(2)①首先写出CO2与H2反应生成甲醇的化学方程式,并注明状态,然后根据盖斯定律求∆H=3∆H1—∆H2= -50 kJ•mol‾1,所以热化学方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H="-50" kJ•mol‾1。
②该反应为放热反应,生成物为液态,放出的热量更多,所以a项图像正确。
(3) ①甲醇失去电子,为电池的负极,所以该电池外电路电子的流动方向为从A到B。
②B电极上O2得电子消耗H+,同时溶液中的H+移向B电极室,所以B电极室溶液的pH与工作前相比将不变。
③CH3OH失电子,生成CO2和H+,根据化合价变化和元素守恒配平方程式:CH3OH+H2O - 6e-=6H++ CO2↑
