下表是氯化钾和硝酸钾在不同温度时的溶解度
| 温度/℃ | O | 20 | 40 | 60 | 80 | |
| 溶解度/g | KCl | 27.6 | 34.O | 40.0 | 45.5 | 51.1 |
| KN03 | 13.3 | 31.6 | 63.9 | 1lO | 169 | |
(1)从表中数据可以看出影响物质溶解度的因素之一是 ;
(2)根据数据表,在答题卷的图中绘制硝酸钾的溶解度曲线;
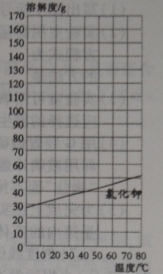
(3)从溶解度曲线上查出:45℃时,氯化钾的溶解度为 g;
(4)据图分析,要除去硝酸钾中混有的少量氯化钾,可采用的结晶方法是 。
(1)温度(或溶质的种类)(2分)
(2)如图 (2分,描点正确,图形完整,曲线平滑)
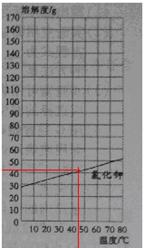
(3)41.0±1 (1分)
(4)降温结晶 (2分)
(1)表中不同温度下氯化钾(或硝酸钾)的溶解度不同,说明温度对物质的溶解度有影响,同一温度下硝酸钾和氯化钾的溶解度不同,且两种物质的溶解度受温度影响的程度不同,所以溶解度与溶质的性质有关;(2)根据数学知识,采用五点法可给出硝酸钾的溶解度曲线;(3)从图中获取氯化钾45℃的溶解度,先从横坐标上找到温度为45℃的点,然后过这点画一条垂直横坐标的直线(或图中红线)然后找到所画红线与氯化钠溶解度曲线的交点,过这个交点作一条平行于横坐标的直线(如图红线所示),再估算出这条红线与纵坐标交点所对应的读数,即为该温度下氯化钾的溶解度,需注意的是,根据图上刻度,读出的数值应该是整数,不宜出现小数。(4)根据表中数据分析,氯化钾的溶解度随温度变化增大,但增大不明显,硝酸钾的溶解度随温度升高而显著增大,即氯化钾的溶解度受温度影响较小,硝酸钾的溶解度受温度影响较大,所以可采取降温结晶的方法除去硝酸钾的少量氯化钾。
