下列数据是氯化钠和氯化钾固体在不同温度时的溶解度.
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| KCl | 27.6 | 34.0 | 40.0 | 45.5 | 51.1 | 56.7 |
(1)在0~20℃时,KCl的溶解度 (填“>”或“<”)NaCl的溶解度.
(2)20℃时,向100g水中加入25g氯化钠,充分溶解后,得到的溶液为 (填“饱和”或“不饱和”)溶液,溶液中溶质质量分数为 .
(3)20℃时,进行了如下图所示的实验.
20℃100g水加KCl20g升温至40℃升温至100℃A B 加KCl20gC 加28g KCl恒温100℃D E
①A~E中,溶液中溶质质量分数相同的是 .
②下列操作能使E溶液中溶质质量分数变小的是 (填字母序号).
a.加入2g KCl b.加入100g 100℃的水 c.降温至40℃
(1)<;(2)不饱和;20%;(3)①CD;②bc.
题目分析:(1)由表中数据可知在0~20℃时,KCl的溶解度<NaCl的溶解度;(2)20℃时氯化钠的溶解度是36g,所以100g水中最多能溶解36g氯化钠,所以20℃时,向100g水中加入25g氯化钠,充分溶解后,得到的溶液为不饱和溶液,溶液中溶质质量分数为: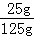 ×100%=20%;(3)①A溶液是不饱和溶液,溶质质量分数是:
×100%=20%;(3)①A溶液是不饱和溶液,溶质质量分数是: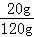 ×100%;B溶液为饱和溶液,溶质质量分数为:
×100%;B溶液为饱和溶液,溶质质量分数为: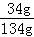 ×100%;C溶液刚好饱和,溶质质量分数为:
×100%;C溶液刚好饱和,溶质质量分数为: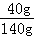 ×100%;D溶液不饱和,溶质质量分数为:
×100%;D溶液不饱和,溶质质量分数为: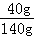 ×100%;E溶液是饱和溶液,溶质质量分数为:
×100%;E溶液是饱和溶液,溶质质量分数为: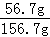 ×100%,由以上分析可知溶液中溶质质量分数相同的是CD;②使E溶液中溶质质量分数变小可能由于溶剂多了,或溶质少了造成的,E中已经饱和再加入2g KCl不能溶解,溶质质量分数不变;加入100g 100℃的水,溶质不变,溶剂多了,溶质质量分数变小;降温至40℃会析出晶体,溶质少了,溶剂不变,溶质质量分数变小.
×100%,由以上分析可知溶液中溶质质量分数相同的是CD;②使E溶液中溶质质量分数变小可能由于溶剂多了,或溶质少了造成的,E中已经饱和再加入2g KCl不能溶解,溶质质量分数不变;加入100g 100℃的水,溶质不变,溶剂多了,溶质质量分数变小;降温至40℃会析出晶体,溶质少了,溶剂不变,溶质质量分数变小.
