如图为A,B,C三种不含结晶水的固体物质溶解度曲线.下列说法不正确的是( )
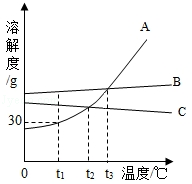
A.t1℃时,65gA的饱和溶液中含有溶质15g
B.要从B的溶液中得到B,通常可采用蒸发溶剂的方法
C.除去A中含有少量的B,可采用冷却热饱和溶液的方法
D.在t2℃时,将A,C两种物质的饱和溶液升温到t3℃后,两种溶液中溶质的质量分数仍相等
答案:D
题目分析:A、t1℃时,A的溶解度是30g,即130g饱和溶液中含有溶质A的质量为30g,所以65gA的饱和溶液中含有溶质15g,正确;
B、B的溶解度受温度影响变化不大,所以要从B的溶液中得到B,通常可采用蒸发溶剂的方法,正确;
C、由图可知:A的溶解度受温度影响较大,B的溶解度受温度影响变化不大,所以除去A中含有少量的B,可采用冷却热饱和溶液的方法,正确;
D、A的溶解度随温度的升高而增大,C的溶解度随温度的升高而减小,饱和溶液中溶质的质量分数的计算式 ×100%;在t2℃时二者的溶解度相等,所以其饱和溶液中溶质的质量分数也相等,将A,C两种物质的饱和溶液升温到t3℃后,A中溶质、溶剂的质量不变,溶质的质量分数不变,C析出晶体,溶质的质量分数不相等,所以两种溶液中溶质的质量分数不相等,A>C,故错误;
×100%;在t2℃时二者的溶解度相等,所以其饱和溶液中溶质的质量分数也相等,将A,C两种物质的饱和溶液升温到t3℃后,A中溶质、溶剂的质量不变,溶质的质量分数不变,C析出晶体,溶质的质量分数不相等,所以两种溶液中溶质的质量分数不相等,A>C,故错误;
故选D.
点评:了解溶解度的概念,明确饱和溶液中溶质的质量分数的计算方法,溶解度曲线的意义,并能将所学知识灵活应用来分析和解答相关问题,是解答此题的关键因素.
