小玉帮助老师配制KNO3的饱和溶液,以备全班实验使用。此实验室温度为25 ℃,老师提供的药品是含有少量NaCl的KNO3固体。
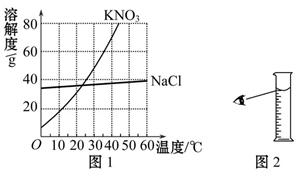
(1)他查阅了两种物质的溶解度曲线,如图1所示。25 ℃时,KNO3的溶解度是___________g,经分析KNO3中混有少量NaCl的提纯方法是______________,用此法获得了足量的KNO3固体。
(2)小玉配制700 g KNO3饱和溶液的过程如下:
①计算;
②称量:准确称量KNO3固体__________g;
③量取:用____________(填“100 mL”“500 mL”或“1 000 mL”)量筒量取蒸馏水,操作如图2所示;
④溶解:将KNO3和水分别加入大烧杯中,搅拌使固体完全溶解。
请指出小玉在配制溶液过程中的操作错误_____________。由于以上错误操作,他配得的不是KNO3饱和溶液,要得到该温度下的饱和溶液,他可能采用的方法是___________________________。最后小玉将配得的饱和溶液装瓶,贴上标签备用。
(1)40 冷却热饱和溶液(或降温结晶)
(2)②200 ③500 mL ④仰视读取水的体积(其他合理表述均可) 蒸发水(溶剂)(答案合理即可)
(1)由图1可看出,25 ℃时,KNO3的溶解度是40 g,根据KNO3和NaCl的溶解度受温度的影响不同,可知宜采用降温结晶的方法提纯KNO3;
(2)700 g KNO3饱和溶液中含KNO3的质量为700 g× ×100%="200" g;含水的体积为(700 g-200 g)÷1 g·mL-1="500" mL,故选用500 mL的量筒量取;仰视读取水的体积会使量取的水偏多,造成配制溶液的质量分数偏小;可采用蒸发溶剂的方法将多余的水蒸发掉。
×100%="200" g;含水的体积为(700 g-200 g)÷1 g·mL-1="500" mL,故选用500 mL的量筒量取;仰视读取水的体积会使量取的水偏多,造成配制溶液的质量分数偏小;可采用蒸发溶剂的方法将多余的水蒸发掉。
