下列说法正确的是( )
A.在100 ℃、101 kPa条件下,液态水的气化热为40.69 kJ·mol-1,则H2O(g) H2O(l) 的 ΔH =" —40.69" kJ·mol-1
H2O(l) 的 ΔH =" —40.69" kJ·mol-1
B.在25℃、101kPa,2mol S的燃烧热是1mol S的燃烧热2倍
C.CH4(g) +2O2(g) =CO2(g) +2H2O(g) ΔH=-akJ·mol-1,这里ΔH代表燃烧热
D.已知:
| 共价键 | C-C | C=C | C-H | H-H |
| 键能/ kJ·mol-1 | 348 | 610 | 413 | 436 |
则可以计算出反应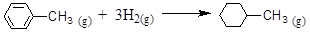 的ΔH为-384 kJ·mol-1
的ΔH为-384 kJ·mol-1
答案:A
题目分析:A.气化热是1mol的物质在一定的条件下由液态变为气态所吸收的热量。在100 ℃、101 kPa条件下,液态水的气化热为40.69 kJ·mol-1,则物质由气态转化为液态释放热量40.69 kJ。则H2O(g)  H2O(l) 的ΔH =" —40.69" kJ·mol-1。正确。B.燃烧热是1mol的物质完全燃烧产生稳定的氧化物时所释放的热量。在25℃、101kPa,2mol S的燃烧放出的热量是1mol S的燃烧放出热量2倍,但是燃烧热是相同的。错误。C.CH4(g) +2O2(g) =CO2(g) +2H2O(g) ΔH=-akJ·mol-1,这里ΔH并不代表燃烧热。因为水在气态时是不稳定的状态,液态才是水的稳定状态。错误。D.在苯分子中不含C-C及C=C,而是存在一种介于单键与双键之间的一种特殊的化学键。因此根据表格提供的数据不能计算出该反应的反应热。正确。
H2O(l) 的ΔH =" —40.69" kJ·mol-1。正确。B.燃烧热是1mol的物质完全燃烧产生稳定的氧化物时所释放的热量。在25℃、101kPa,2mol S的燃烧放出的热量是1mol S的燃烧放出热量2倍,但是燃烧热是相同的。错误。C.CH4(g) +2O2(g) =CO2(g) +2H2O(g) ΔH=-akJ·mol-1,这里ΔH并不代表燃烧热。因为水在气态时是不稳定的状态,液态才是水的稳定状态。错误。D.在苯分子中不含C-C及C=C,而是存在一种介于单键与双键之间的一种特殊的化学键。因此根据表格提供的数据不能计算出该反应的反应热。正确。
