化学键的键能是指气态原子间形成1mol化学键时释放的能量。如:H(g)+I(g)→H-I(g)+297KJ 即H-I键的键能为297kJ/mol,也可以理解为破坏1mol H-I键需要吸收297KJ的热量。化学反应的发生可以看成旧化学键的破坏和新化学键的形成。下表是一些键能数据。(单位:kJ/mol)
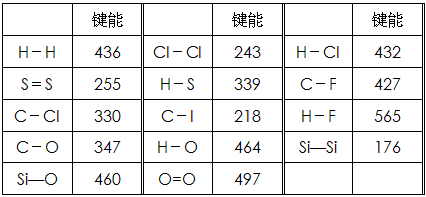
阅读上述信息,回答下列问题:
(1)根据表中数据判断CCl4的稳定性_________(填“大于”或“小于”)CF4的稳定性。试预测C-Br键的键能范围_________<C-Br键能<_________
(2)结合表中数据和热化学方程式H2(g)+Cl2(g)=2HCl(g) ΔH=-QKJ/ mol;通过计算确定热化学方程式中Q的值为______________
(3)有人认为:H-O键的键能大于H-S键的键能,所以H2O的熔沸点高于H2S的熔沸点。你是否赞同这种观点?如不赞同,请说出你的解释。________________________________________
(4)①Si-Si键能小于Si-O键能的理由是:________________________________
②请写出晶体硅与氧气反应生成二氧化硅的热化学方程式:______________________________
(1)小于;218KJ·mol-1;330KJ·mol-1
(2)185
(3)不赞同,H2O的熔沸点高于H2S是因为水分子间存在氢键,与键能无关
(4)①Si原子半径大于O原子,所以Si-Si的键长大于Si-O的键长,因而前者键能小于后者
②Si(s)+O2(g)=SiO2(s) △H=-991kJ/mo1
