下图是A、B、C三种物质的溶解度曲线,下列分析正确的是
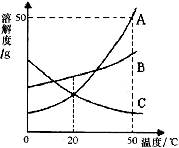
A.50℃时A、B、C三种物质的溶解度由大到小的顺序是A>B>C
B.50℃时把50gA放入50g水中能得到A的饱和溶液,其中溶质与溶液的质量比为1:2
C.将C的饱和溶液变为不饱和溶液,采用降温结晶方法
D.将50℃时A、B、C三种物质的饱和溶液降温至20℃时,这三种溶液的溶质质量分数的大小关系是B>A=C
A
题目分析:仔细解读A.B.C三种固体物质的溶解度曲线,A.在50℃时A.B.C三种物质的溶解度由大到小的顺序是A>B>C,故说法正确;B.在50℃时,A物质的溶解度是50g,把50gA放入50g水中能得到A的饱和溶液,只能溶解25gA物质,溶质与溶液质量比为25g:(25g+50g)=1:3,故说法正确;C. C物质的溶解度随温度降低而减小,将C的饱和溶液变为不饱和溶液,可采用降温的方法,故C正确;D.将50℃时A.B.C三种物质的饱和溶液降温度20℃时,由于A.B的溶解度随温度的降低而减小,形成的是20℃时饱和溶液;由于C的溶解度随温度的降低而增大,溶液中溶质的质量分数就是50℃时饱和溶液溶质的质量分数;由于20℃时A.B的溶解度与C物质在50℃时溶解度的大小关系是:B>A>C.所以,三种溶液的溶质质量分数的大小关系是:B>A>C,故D错误.
