海水的综合利用可以制备金属镁,其流程如下图所示
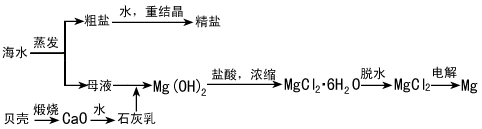
(1)石灰乳主要成分的化学式是___________。
(2)粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,
粗盐溶于水过滤,在滤液中加入NaOH后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)、③BaCl2,这3种试剂添加的合理顺序是______________(填序号)
(3)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。
____________________________________________
(4)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl或MgO,写出相应反应的化学方程式。
______________________、______________________
(5)用电解法制取金属镁时,需要无水氯化镁。在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水
MgCl2,其原因是______________________。
(6)用电解无水MgCl2制取金属镁时,阴极的电极反应式是______________________;电解精制饱和
NaCl溶液时,阴极的电极反应式是______________________。
(1)Ca(OH)2
(2)③①②
(3)加入盛有足量MgCl2溶液的烧杯中,充分搅拌,过滤,沉淀用水洗涤。
(4)MgCl2·6H2O Mg(OH)Cl+HCl↑+5H2O↑;MgCl2·6H2O
Mg(OH)Cl+HCl↑+5H2O↑;MgCl2·6H2O MgO+2HCl↑+5H2O↑(或Mg(OH)Cl
MgO+2HCl↑+5H2O↑(或Mg(OH)Cl MgO+
MgO+
HCl↑)
(5)在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2·6H2O受热产生的水气,故能得到无水
MgCl2
(6)Mg2++2e-=Mg、2H++2e-= H2↑
