问题
计算题
某化学活动小组用稀盐酸对赤铁矿中Fe2O3 的含量进行测定(杂质不与盐酸反应且不溶于水),得到一黄色残液。为防止直接排放造成环境污染, 对其进行了处理,过滤该残液,取100 g 滤液,向其中不断加入某未知溶质质量分数的氢氧化钠溶液,所得实验数据如下表:

通过对上述实验数据的分析,选择合理的数据,计算所加氢氧化钠溶液的溶质质量分数【资料:FeCl3+3NaOH==Fe(OH)3↓+3NaCl】
答案
解:从表格数据可以看出,加入40 g NaOH 溶液时没有沉淀生成,可推断出,残液的滤液中除FeCl3 外还含有HCl 。
在氢氧化钠溶液过量的情况下,最多生成5.35 g Fe( OH)3 沉淀。
设与氯化铁反应的NaOH 的质量为x
FeCl3+3NaOH==Fe(OH)3 ↓+3NaCl
120 107
x 5. 35 g
 ,x=6 g
,x=6 g
故所加氢氧化钠溶液中溶质的质量分数为: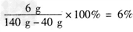
答:所加氢氧化钠溶液的溶质质量分数为6%.
