问题
填空题
一种以黄铜矿和硫磺为原料制备铜和其他产物的新工艺的原料综合利用率较高。其主要流程如下:
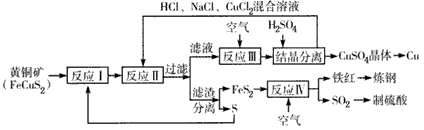
注:反应Ⅱ的离子方程式为Cu2+ +CuS+4Cl- ==2CuCl2-+S 请回答下列问题:
(1)反应I的产物为___(填化学式)。
(2)反应Ⅲ的离子方程式为___。
(3)一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其原因是___。
(4)炼钢时,可将铁红投入熔融的生铁中,该过程中主要反应的化学方程式是___。
(5)某硫酸厂为测定反应Ⅳ所得气体中SO2的体积分数,取280 mL(已折算成标准状况)气体样品与足量
Fe2(SO4)3 溶液完全反应后,用浓度为0. 02000 mol.L-1的K2Cr2O7标准溶液滴定至终点,消耗25.00 mL
K2Cr2O7溶液。 已知:Cr2O72- +Fe2+ +H+→Cr3+ +Fe3+ +H2O(未配平)
①将SO2通入Fe2(SO4)3溶液中,发生反应的离子方程式为____。
②反应Ⅳ所得气体中SO2的体积分数为____。
答案
(1) FeS2 、CuS
(2)4CuCl2-+O2+4H+==4Cu2+ +8Cl- +2H2O
(3)该温度下,硫酸铜的溶解度小于氯化铜
(4)3C+Fe2O3 2Fe +3CO↑
2Fe +3CO↑
(5)①SO2+2Fe3++2H2O==SO42- +2Fe2+ +4H+ ;②12. 00%

