(14分)实验室中所用少量氯气是用下列方法制取的,
4HCl(浓)+MnO2 Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O
试回答下列问题:
(1)该反应是氧化还原反应吗? ,如果是氧化还原反应,请指出___ 是氧化剂, 是还原剂,_________是氧化产物,________是还原产物,根据上述氧化还原反应式判断氧化性:______﹥_______;还原性:______﹥_______。
⑵写出该反应的离子方程式 _________
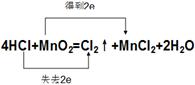
⑶用双线桥法标出该反应电子转移的方向和数目 _______________________________
. ⑴ 是 MnO2 HCl Cl2 MnCl2 MnO2﹥Cl2 HCl﹥MnCl2
(2)4H++2Cl-+MnO2 Cl2↑+Mn2++2H2O
Cl2↑+Mn2++2H2O
(3) 
题目分析:(1)根据反应的方程式可知,氯元素的化合价从-1价升高到0价,而锰元素的化合价从+4价降低到+2价,所以属于氧化还原反应。其中氧化剂是二氧化锰,HCl是还原剂。氯气是氧化产物,而氯化镁是还原产物。由于在氧化还原反应中氧化剂的氧化性强于氧化产物的,还原剂的还原性强于还原产物的,所以氧化性和还原性强弱顺序分别是MnO2﹥Cl2、HCl﹥MnCl2。
(2)氯化氢和氯化锰都是可以拆开的,所以该反应的离子方程式是
4H++2Cl-+MnO2 Cl2↑+Mn2++2H2O。
Cl2↑+Mn2++2H2O。
(3)双线桥中起点和终点的元素是同一种,所以该氧化还原反应的表示是

点评:在进行氧化还原反应的有关判断时,关键时准确标出有关元素的化合价变化情况,然后依据有关的概念进行分析判断即可。
