某化学研究性学习小组在实验室中模拟海水提取溴的过程,其实验流程如下:
海水除去悬浮 杂质 浓缩 氯化剂 氯化
Br2(g)热空气
Na2CO3溶液 吸收
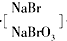
Br2H2SO4
(1)取24L除去悬浮杂质后的海水,浓缩至2L;
(2)向其中通入足量Cl2,反应的离子方程式: ,通入热空气的目的: ;
(3)将吹出的Br2用纯碱溶液吸收,反应得到NaBr、NaBrO3和CO2,反应的化学方程式: ,产生的CO2通入足量澄清石灰水中,得到1g白色沉淀;
(4)将吸收Br2的溶液用足量硫酸处理得到Br2单质,反应的化学方程式: ,理论上可以得到Br2的质量为 ;
(5)请计算海水中溴的浓度为 g/L.
解析:通过反应Cl2+2Br-═Br2+2Cl-置换出溴单质后,一般用热空气或水蒸气将Br2吹出;根据各步反应,可确定如下关系:Br2~CO2~CaCO3,根据CaCO3的质量
可求出原24L海水中Br2的质量为
=1.6 g,160g/mol×1g 100g/mol
则海水中溴的浓度为
=0.067 g/L.1.6g 24L
(2)因氯气具有氧化性,能氧化溴离子生成单质溴:Cl2+2Br-═Br2+2Cl-;
因溴易挥发,所以一般用热空气或水蒸气将Br2吹出,故答案为:将Br2吹出;
(3)生成一个NaBr化合价降低1,生成一个NaBrO3化合价升高5,根据化合价升降总数相等和质量守恒来配平得:
3Br2+3Na2CO3═5NaBr+NaBrO3+3CO2↑,故答案为:3Br2+3Na2CO3═5NaBr+NaBrO3+3CO2↑;
(4)因Br-和BrO3-在酸性条件下发生归中反应生成Br2:5NaBr+NaBrO3+3H2SO4═3Br2+3Na2SO4+3H2O,
故答案为:5NaBr+NaBrO3+3H2SO4═3Br2+3Na2SO4+3H2O;
根据各步反应,得如下关系:CaCO3 ~CO2~Br2
100 160
1g 1.6 g
所以得到Br2的质量为1.6g,故答案为:1.6 g;
(5)海水中溴的浓度为
=0.067 g/L,故答案为:0.067.1.6g 24L
