工业上对海水资源综合开发利用的部分工艺流程如图所示.
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,粗制后可得饱和NaCl溶液,精制时通常在溶液中依次中加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液,过滤后向滤液中加入盐酸至溶液呈中性.请写出加入Na2CO3溶液后相关化学反应的离子方程式:______、______.
(2)从海水中提取溴,主要反应为2Br-+Cl2=Br2+2Cl-,下列说法错误的是______(填序号).
A.溴离子具有氧化性 B.氯气是还原剂
C.该反应属于复分解反应 D.Br2是氧化产物
(3)本工艺流程中先后制得Br2、CaSO4、Mg(OH)2,能否按Br2、Mg(OH)2、CaSO4的顺序制备?______(填“能”或“否”),原因是______.
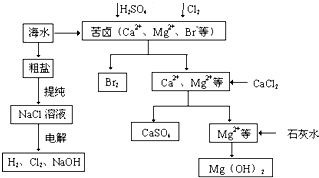
(1)Na2CO3可以把过量的钡离子转化为沉淀:Ba2++CO32-=BaCO3↓,Na2CO3可以和钙离子结合生成沉淀:Ca2++CO32-=CaCO3↓,故答案为:Ba2++CO32-=BaCO3↓;Ca2++CO32-=CaCO3↓;
(2)A、因溴离子化合价升高是还原剂具有还原性,故A错误;
B、因氯气的化合价降低,是氧化剂,故B错误;
C、因反应2Br-+Cl2=Br2+2Cl-是置换反应,故C错误;
D、因Br-的化合价升高是还原剂,对应的产物Br2是氧化产物,故D正确;
故选:ABC.
(3)因先沉淀Mg(OH)2,则沉淀中会夹杂有Ca(OH)2沉淀,造成产品不纯,
故答案为:否、如果先沉淀Mg(OH)2,则沉淀中会夹杂有Ca(OH)2沉淀,产品不纯.
