(5分)二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式____ ____。
(2)已知:Se+2H2SO4(浓)→2SO2↑+SeO2+2H2O ; 2SO2+SeO2+2H2O→Se+2SO42-+4H+
则SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是____ __。
(3)回收得到的SeO2的含量,可以通过下面的方法测定,测定的原理如下:反应①发生后产生的I2,I2的量在反应②中被滴定,淀粉为指示剂,以Na2S2O3溶液为标准溶液
①SeO2+KI+HNO3→Se+I2+KNO3+H2O
②I2+2Na2S2O3→Na2S4O6+2NaI
实验中,准确称量SeO2样品0.2500g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为_ __。
(5分)(1)Se+2HNO3(浓)=H2SeO3+NO↑+NO2↑ (2分);
(2)H2SO4(浓)>SeO2>SO2 (1分)
(3)0.555(2分)
考查氧化还原反应的有关判断及计算等。
(1)根据还原产物NO和NO2的物质的量是1︰1可知,在反应中Se被浓硝酸氧化生成+4价的H2SeO3,所以反应的方程式是Se+2HNO3(浓)=H2SeO3+NO↑+NO2↑。
(2)在氧化还原反应中,氧化剂的氧化性强于氧化产物的,而还原剂的还原性强于还原产物的。所以根据反应的方程式可知,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>SO2。
(3)根据反应的方程式可知,SeO2~2I2~4Na2S2O3。所以样品中SeO2的物质的量是0.2000 mol/L×0.025L÷4=0.00125mol,则SeO2的质量是0.00125mol×111g/mol=0.13875g,所以样品中SeO2的质量分数为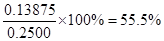 。
。
