问题
计算题
实验室保存的一瓶浓盐酸,瓶上的标签部分内容如图所示,请你根据标签上的提供的数据回答下列问题:
(1)瓶内浓盐酸的质量是_________g;
(2)用5mL该浓盐酸可以配制溶质质量分数是10%的盐酸_________g(答案保留一位小数);
(3)现用刚配好的20g10%的盐酸与足量的锌粒完全反应,制得标准状况下的氢气0.54L,通过计算判断实验室中浓盐酸是否有部分氯化氢挥发(标准状况下氢气的密度是0.09g/L).

答案
(1)595;
(2)22.0;
(3)解:设产生0.54L氢气需要氯化氢的质量为X.
Zn+2HCl==ZnCl2+H2↑
73 2
x 0.54L×0.09g/L
 =
=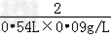
因为 X=1.77g<20g×10%,所以有部分氯化氢挥发.

