从海水中可以获得淡水、食盐并可提取镁和溴等物质.
(1)贝壳的主要成分是______(填化学式);海水淡化的方法主要有______(填一种).
(2)经过化学变化才能从海水中获得的物质是______(填序号)
A.氯、溴、碘 B.钠、镁、铝 C.烧碱、氢气 D.食盐、淡水
(3)从海水中提取镁的流程如图所示:
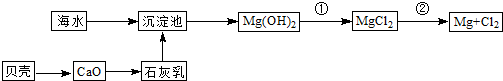
反应①的离子方程式为______.
反应②的化学方程式为______.
(4)从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式为______.
(1)因贝壳的主要成分是碳酸钙,其化学式为CaCO3,因海水淡化的常用方法:海水冻结法、电渗析法、蒸馏法、离子交换法,
故答案为:CaCO3;海水冻结法、电渗析法、蒸馏法、离子交换法(选填其中一个);
(2)A.通过电解熔融氯化钠得到钠和氯气,是化学变化,通过氯气将溴离子和碘离子氧化为溴单质和碘单质,是化学变化,故A错误;
B.通过电解熔融氯化钠得到钠和氯气,是化学变化,通过电解熔融的氯化镁和氧化铝即得镁和铝,是化学变化,故B错误;
C.可从海水中获得氯化钠,然后电解饱和食盐水,即得烧碱、氢气和氯气,是化学变化,故C错误;
D.把海水用蒸馏等方法可以得到淡水,把海水用太阳暴晒,蒸发水分后即得食盐,不需要化学变化就能够从海水中获得,故D正确;
故答案为:D;
(3)因反应①是Mg(OH)2与盐酸反应:Mg(OH)2+2HCl=MgCl2+2H2O,离子方程式:Mg(OH)2+2H+═Mg2++2H2O,反应②是电解熔融MgCl2:MgCl2(熔融)
Mg+Cl2↑, 通电 .
故答案为:Mg(OH)2+2H+═Mg2++2H2O;MgCl2(熔融)
Mg+Cl2↑; 通电 .
(4)因氯气能氧化溴离子得到氯离子和单质溴:2Br-+Cl2═Br2+2Cl-;故答案为:2Br-+Cl2═Br2+2Cl-.
