(三选一)【选修2:化学与技术】
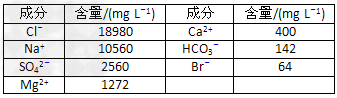
海水资源的利用具有广阔前景。海水中主要离子的含量如下:
(1)电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。
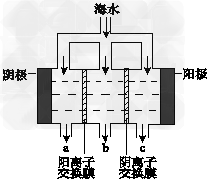
①阳极主要电极反应式是________________。
②在阴极附近产生少量白色沉淀,其成分有_______和CaCO3,生成CaCO3的离子方程式是____________________。
③淡水的出口为________(填“a”、“b”或“c”)。
(2)利用海水可以提取溴和镁,提取过程如下:
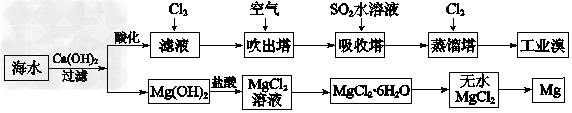
①提取溴的过程中,经过2次Br-→Br2转化的目的是_________________,吸收塔中发生反应的离子方程式是_______________。用平衡移动原理解释通空气的目的是_________________________。
②从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是_________、过滤、洗涤、干燥。
③依据上述流程,若将10 m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为______L(忽略Cl2溶解)。
(1)①2Cl--2e-=Cl2↑;②Mg(OH)2;Ca2++ OH-+HCO3-=CaCO3↓+H2O;③b
(2)①对溴元素进行富集;SO2+Br2+2H2O=4H++2Br-+SO42-;通空气将Br2蒸气带出使Br2(g) Br2(aq)或Br2+H2O
Br2(aq)或Br2+H2O HBr+HBrO平衡向左移动;②加热浓缩、冷却结晶;③179.2
HBr+HBrO平衡向左移动;②加热浓缩、冷却结晶;③179.2
