问题
填空题
三氟化氮(NF3)是一种无色无味的气体,可由氟与氨反应制得。
(1)该反应的方程式为NH3+F2→NF3+NH4F,配平方程式并标明电子转移的方向和数目。
(2)27.0 mL NF3和水充分反应,生成 18.0 mL NO(同温、同压下),写出反应的化学方程式:___________________________________。
(3)NF3是一种无色无味的气体,但一旦NF3在空气中泄漏,还是易于发现的。该气体泄漏时的现象是 。
答案
(1) 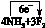 ===NF3+3NH4F (2)3NF3+5H2O===2NO+HNO3+9HF
===NF3+3NH4F (2)3NF3+5H2O===2NO+HNO3+9HF
(3)产生红棕色气体、产生刺激性气味气体、产生白雾
(1)根据方程式可知,氨气中氮元素的化合价从-3价升高到+3价,失去6个电子;氟元素的化合价从0价降低到-1价,得到1个电子,所以根据电子的得失守恒可知,还原剂与氧化剂的物质的量之比是1︰3,所以配平后的方程式是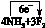 ===NF3+3NH4F。
===NF3+3NH4F。
(2)根据阿伏加德罗定律可知,NF3和NO的物质的量之比是3︰2,则根据电子的得失守恒可知,氧化产物是硝酸,因此反应的方程式是3NF3+5H2O===2NO+HNO3+9HF。
(3)由于NF3极易与水反应生成NO和硝酸,所以一旦泄露的现象就是产生红棕色气体、产生刺激性气味气体、产生白雾。
