(6分)为了预防环境污染并对尾气进行综合利用,某硫酸厂用氨水吸收尾气中的SO2。再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。
为测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品4份,分别加入相同浓度的NaOH溶液各40.00 mL,加热至120 ℃左右,使氨气全部逸出〔(NH4)2SO4和NH4HSO4固体分解的温度均高于200 ℃〕,测得有关实验数据如下:(标准状况下)
| 实验序号 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
| Ⅰ | 7.4 | 40.00 | 1.68 |
| Ⅱ | 14.8 | 40.00 | 3.36 |
| Ⅲ | 22.2 | 40.00 | 1.12 |
| Ⅳ | 37.0 | 40.00 | 0.00 |
(2)由Ⅰ组数据直接推测:标准状况下3.7 g样品进行同样实验时,生成氨气的体积为__________L。
(3)试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比为__________________。
(4)欲计算该NaOH溶液的物质的量浓度应该选择__________组数据,由此求得NaOH溶液的物质的量浓度为____________________________________________________________。
(1)H++OH-====H2O, +OH-
+OH-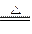 NH3↑+H2O (2)0.84 (3)1∶4 (4)Ⅲ 5 mol·L-1
NH3↑+H2O (2)0.84 (3)1∶4 (4)Ⅲ 5 mol·L-1
(1)(NH4)2SO4和NH4HSO4在溶液中是完全电离的,所以(NH4)2SO4和NH4HSO4固体混合物中加入NaOH溶液时,将有以下两个离子反应发生H++OH-====H2O, +OH-
+OH-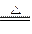 NH3↑+H2O。
NH3↑+H2O。
(2)由表中数据可看出,当样品质量由7.4 g增加到14.8 g时,释放出的气体体积由1.68 L增加到3.36 L,是成比例增加的,说明NaOH溶液此时是足量的。所以可推断出当样品的质量为3.7 g时,所释放出的气体体积应为1.68 L/2="0.84" L。
(3)设I组混合物中(NH4)2SO4的物质的量为x mol,NH4HSO4的物质的量为y mol,依据表中的数据有:当混合物质量为14.8 g时,产生气体NH3的物质的量为3.36 L/22.4 L·mol-1="0.15" mol。
(NH4)2SO4—2NH3 NH4HSO4—NH3
x mol 2x mol y mol y mol
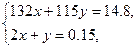 解此方程组得到:x=0.025,y=0.1。
解此方程组得到:x=0.025,y=0.1。
所以,混合物中(NH4)2SO4和NH4HSO4的物质的量之比为0.025∶0.1=1∶4。
(4)分析表中数据,当加入样品质量为22.2 g时,放出的气体体积不再与样品质量成比例,说明此时NaOH的量不足,但可以判断出,此时的NaOH消耗完了全部的H+,并消耗了部分的 。当加入样品为37.0 g时,无气体释放,这表明此时NaOH全部被溶液中的H+消耗。计算该NaOH溶液的物质的量浓度应该选择Ⅲ组数据进行计算。
。当加入样品为37.0 g时,无气体释放,这表明此时NaOH全部被溶液中的H+消耗。计算该NaOH溶液的物质的量浓度应该选择Ⅲ组数据进行计算。
结合(3)的计算结果可知,在22.2 g样品中含(NH4)2SO4应为0.025 mol×1.5="0.037" 5 mol,含有NH4HSO4的物质的量为0.1 mol×1.5="0.15" mol。
由于H+—NaOH,则溶液中的H+消耗的NaOH为0.15 mol。
由于 —NaOH—NH3,溶液中的
—NaOH—NH3,溶液中的 消耗的NaOH为1.12 L/2.24 L·mol-1="0.05" mol。
消耗的NaOH为1.12 L/2.24 L·mol-1="0.05" mol。
所以,NaOH的总物质的量为0.15 mol+0.05 mol="0.2" mol。
NaOH溶液的物质的量浓度为0.2 mol/0.04 L="5" mol·L-1。
