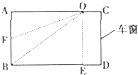
某工厂废水中含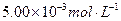 的
的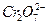 ,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料
,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料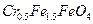 的流程图:
的流程图:
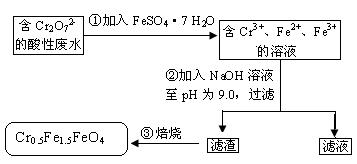
下列有关判断错误的是
A.操作①中反应的离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
B.操作②所得的滤渣成分主要为Fe(OH)3、Fe(OH)2、Cr(OH)3
C.磁性材料Cr0.5Fe1.5FeO4中,显+3价铁与显+2价的铁的质量之比为2:3
D.若废水中杂质不与绿矾反应,将该l L废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4,理论上需加入绿矾13.9 g
C
①步骤,在酸性溶液中Cr2O72-与Fe2+反应生成Cr3+,Fe3+,H2O 离子方程式为
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,A选项正确;向含Fe2+、Fe3+、Cr3+的溶液中加入氢氧化钠溶液后,得到三种沉淀:Fe(OH)2、Fe(OH)3、Cr(OH)3,B选项正确;这三种氢氧化物焙烧失水得到磁性材料Cr0.5Fe1.5FeO4,元素化合价没有变化,该化学式中Cr显+3价,若+2价铁为1.5 mol,+3价铁为1 mol,则正化合价代数和为3×0.5+2×1.5+3×1=7.5,负化合价代数和为(-2)×4=8,化学式总的化合价代数之和不等于0,由此说明,+2价铁为1mol,+3价铁为1.5 mol,故说明该材料中,n(Fe2+):n(Fe3+)=1mol:1.5mol=2:3,C选项不正确;D选项,根据关系式知:Cr2O72-~4Cr0.5Fe1.5FeO4~10 FeSO4·7 H2O 。理论上,1L废液中含有Cr2O72-:n(Cr2O72-)=5.00×10-3 mol/L×1 L=5.00×10-3mol,根据(1)中离子方程式知,理论上需要绿矾:m(FeSO4·7H2O)=5.00×10-3mol×278 g/mol="13.9" g,D选项正确。