甲醇是一种优质的液体燃料,CO和CO2均可用于合成甲醇。
目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g) +3H2(g) =CH3OH(g)+H2O(g) △H1
(1)已知:2CO(g) +O2(g) =2CO2(g) △H2
2H2(g)+O2(g) =2H2O(g) △H3
则CO(g) + 2H2(g)  CH3OH(g)的△H= 。
CH3OH(g)的△H= 。
(2)由CO合成甲醇时,CO在不同温度下的平衡转化率与压强的关系如下图所示。

该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
(3)
一定温度下,向2L密闭容器中加入1mol CH3OH (g),发生反应:CH3OH(g)  CO(g) + 2H2(g),H2物质的量随时间的变化如图所示。0~2 min内的平均反应速率v(CH3OH)= 。
CO(g) + 2H2(g),H2物质的量随时间的变化如图所示。0~2 min内的平均反应速率v(CH3OH)= 。
该温度下,CO(g) + 2H2(g)  CH3OH(g)的平衡常数K= 。
CH3OH(g)的平衡常数K= 。
相同温度下,若开始加入CH3OH(g)的物质的量是原来的2倍,则 是原来的2倍。
a.平衡常数 b.CH3OH的平衡浓度 c.达到平衡的时间 d.平衡时气体的密度
(4)以CH3OH为燃料(以KOH溶液作电解质溶液)可制成CH3OH燃料电池。
①充入CH3OH的电极为 极;
②负极反应的电极反应式为 。
(1)△H1+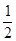 △H2 -
△H2 -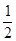 △H3 。(2分)
△H3 。(2分)
(2)<;(1分) 在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失。(3分)
(3)0.125mol·L-1· min-1;(2分) 4 L2·mol-2;(2分) d。(1分)
(4)①负;(1分) ②CH3OH - 6e-+8OH-= CO32-+6H2O。(2分)
(1)根据盖斯定律①+ ②—
②— ③可知,CO(g) + 2H2(g)
③可知,CO(g) + 2H2(g)  CH3OH(g) △H=△H1+
CH3OH(g) △H=△H1+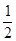 △H2 -
△H2 -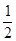 △H3
△H3
(2)由图示可知,在相同的压强下,升高温度时CO的转化率降低,即升温平衡左移,正反应是放热反应,ΔH<0
相对低温有利于提高产率,且在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失,故选择条件为250℃、1.3×104kPa
(3)反应:CH3OH(g)  CO(g) + 2H2(g)
CO(g) + 2H2(g)
初n: 1 0 0
△n: 0.5 0.5 1
平衡n: 0.5 0.5 1
v(CH3OH)=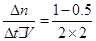 = 0.125mol·L-1· min-1;
= 0.125mol·L-1· min-1;
该温度下,CO(g) + 2H2(g)  CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=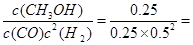 4 L2·mol-2;
4 L2·mol-2;
恒容、恒温情况下,若开始加入CH3OH(g)的物质的量是原来的2倍:
a.平衡常数只与温度有关,是定值;
b.相当于加压,CH3OH的平衡浓度将大于原平衡浓度的两倍
c.增加反应物浓度,反应速率加快,达到平衡的时间将减小,但没有定量关系
d.混合物的质量为原先的两倍,故平衡时气体的密度为原先的两倍,符合题意
(4)燃料电池中通入氧气的一极得电子,为正极,而燃料甲醇失电子,做负极
电池总反应为:2CH3OH+3O2+4OH—=6H2O+2 CO32-
正极反应为:O2+4e-+2H2O=4OH-
总反应减去正极反应得到负极反应:CH3OH - 6e-+8OH-= CO32-+6H2O
