(13分)工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂
亚氯酸钠(NaClO2),其工艺流程如下:
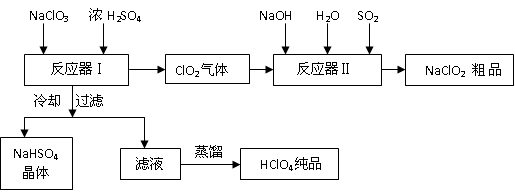
已知:
1.NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出。
2.高氯酸是至今为止人们已知酸中的最强酸,沸点90℃。
请回答下列问题
(1)反应器Ⅰ中发生反应的化学方程式为 ,冷却的目的是 ,能用蒸馏法分离出高氯酸的原因是 。
(2)反应器Ⅱ中发生反应的离子方程式为 。
(3)通入反应器Ⅱ中的SO2用另一物质H2O2代替同样能生成 NaClO2 ,请简要说明双氧水在反应中能代替SO2的原因是
(4)Ca(ClO)2 、ClO2、NaClO、NaClO2 等含氯化合物都是常用的消毒剂和漂白剂是因为它们都具有 请写出工业上用氯气和NaOH溶液生产另一种消毒剂 NaClO的离子方程式
(13分)(1)3NaClO3+3H2SO4=HClO4+2ClO2+3NaHSO4+H2O;(2分)
降低NaHSO4的溶解度,使NaHSO4结晶析出(2分)高氯酸的沸点低(1分)
(2)2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O;(2分)
(3)H2O2有还原性也能把ClO2还原为NaClO2 (2分)
(4)强氧化性(2分) Cl2 + 2OH- = ClO- + Cl- + H2O;(2分)
(1)反应器Ⅰ中发生反应的化学方程式为:3NaClO3+3H2SO4=HClO4+2ClO2+3NaHSO4+H2O;冷却的目的是:降低NaHSO4的溶解度,使NaHSO4结晶析出;能用蒸馏法分离出高氯酸的原因是:高氯酸的沸点低。
(2)反应器Ⅱ中发生反应的离子方程式为:2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O;
(3)通入反应器Ⅱ中的SO2用另一物质H2O2代替同样能生成 NaClO2 ,双氧水在反应中能代替SO2的原因是:H2O2有还原性也能把ClO2还原为NaClO2 。
(4)Ca(ClO)2 、ClO2、NaClO、NaClO2 等含氯化合物都是常用的消毒剂和漂白剂是因为它们都具有强氧化性,用氯气和NaOH溶液生产另一种消毒剂 NaClO的离子方程式为:Cl2 + 2OH- = ClO- + Cl- + H2O
