现有一份由碳酸钠和氯化钠组成的固体样品,质量为10g.重庆一中初三化学兴趣小组的同学设计了如图中的装置,请你与他们一起探究.
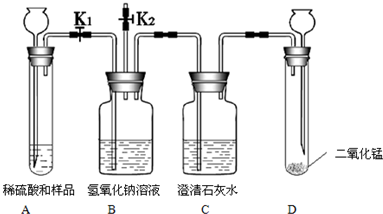
【实验目的】测定样品中碳酸钠的质量分数并探究碳酸钠的化学性质.
【实验步骤】
①检查装置气密性.
②关闭止水夹K2,打开止水夹K1.向装有样品的A装置内加入适量的稀硫酸,充分反应后,B装置的质量增重2.2g,C装置中的澄清石灰水不变浑浊.
③关闭止水夹K1,打开止水夹K2,使B装置与空气连通.向D装置内加入适量的过氧化氢溶液充分反应(确保溶液浸没长颈漏斗下端管口).
请回答:
(1)A装置中的实验现象为______;
(2)样品中碳酸钠的质量分数为______;
(3)当向D装置内加入适量的过氧化氢溶液时,C装置出现的现象是______;
(4)在整个反应过程中,B装置内所发生反应的化学方程式为______.______
【实验拓展】反应结束后,B装置溶液中溶质的组成是怎么样的呢?同学们提出了自己的猜想.
小丽认为只有氢氧化钠;
小明认为是氢氧化钠和氢氧化钙;
小方认为是氢氧化钠和______(写化学式).
【实验验证】
| 实验内容 | 现象 | 结论 |
| 取少量B装置溶液于试管中,加入 ______(写化学式), | ______ | 小明同学的猜想正确 |
(1)如样品中含有碳酸钠就会和稀硫酸反应生成二氧化碳气体,现象就是在A装置内冒出气泡;
(2)由题意知,B装置的质量增重2.2g就是碳酸钠和稀硫酸反应产生的二氧化碳的质量,由此设碳酸钠的质量为x.
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
x 2.2g
=106 44 x 2.2g
x=5.3g
所以样品中碳酸钠的质量分数为:
×100%=53%5.3g 10g
(3)依据过氧化氢与二氧化锰混合会生成氧气,从而导致C装置内气体压强变大,就会使C中清石灰水被压入到左侧导管并进入B中;
(4)由题意知,B装置内发生反应有A装置反应产生的二氧化碳和氢氧化钠反应生成碳酸钠和水,还有D装置中产生的氧气把C装置中的石灰水压入B装置中与生成的碳酸钠反应生成氢氧化钠和碳酸钙,故答案为:CO2+2NaOH=Na2CO3+H2O、Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
【实验拓展】B装置内如生成的碳酸钠和氢氧化钙恰好完全反应,溶液中溶质的组成就只含有氢氧化钠,如碳酸钠剩余就含有NaOH和Na2CO3,如石灰水剩余就含有 NaOH和Ca(OH)2;
验证溶质含有氢氧化钠和氢氧化钙,就验证溶液中没有钙离子,具体方法是:过滤后取滤液于试管中,向试管滴加足量的碳酸钠,若出现白色沉淀(氢氧化钙与碳酸钠反应的结果),则溶质是NaOH和Na2CO3.
故答案为:(1)有气泡生成;(2)53%;(3)澄清石灰水被压入到左侧导管并进入B中;(4)CO2+2NaOH=Na2CO3+H2O;Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
【实验拓展】Na2CO3;Na2CO3;有白色沉淀生成;
