问题
填空题
请回答下面问题
(1)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表
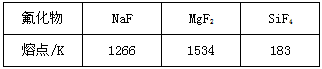
解释表中氟化物熔点差异的原因:____________________________________
(2)CO的结构可表示为C≡O,N2的结构可表示为N≡N。下表是两者的键能数据:(单位:kJ·mol-1)
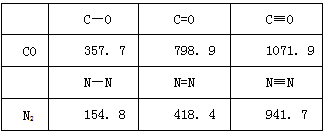
CO与N2的结构相似,分子中都含有共价三键,其中含有___________个π键;结合数据说明CO比N2活泼的原因:____________________________________
答案
(1)NaF、MgF2为离子晶体,SiF4为分子晶体,所以NaF、MgF2的熔点远比SiF4熔点要高,又因为Mg2+
半径小于Na+的半径,所以MgF2的离子键强度大于NaF的离子键强度,故MgF2的熔点大于NaF的熔点。
(2)2;打开CO的第一个化学键所需的能量:1071.9-798.9=273kJ/mol,打开N2的第一个化学键所需的能量:941.7-418.4=523.3kJ/mol,前者所需的能量小,故CO更活泼
