A、B、C、D四种元素,A元素所处的周期数,主族序数,原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C.
(1)B元素的名称______,B在周期表中的位置______,
(2)A、B形成的化合物的电子式______;
(3)C的元素符号______,C的最高价氧化物的化学式______;
(4)D的最高价氧化物的水化物中含有______键.
(5)用电子式表示D2C的形成过程:______.
A元素所处的周期数,主族序数,原子序数均相等,则A为H;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3,则B为N;C元素原子的最外层电子数比次外层少2个,C有3个电子层,最外层电子数为6,则C为S;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C,则D在第四周期第ⅠA族,即D为K,
(1)B为N,其名称为氮,原子结构中有2个电子层,最外层电子数为5,故答案为:氮;第二周期第VA族;
(2)A、B形成的化合物为NH3,其电子式为
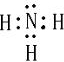
,故答案为:
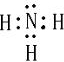
;
(3)C的元素符号为S,最高价为+6价,则最高价氧化物为SO3,故答案为:S;SO3;
(4)D的最高价氧化物的水化物为KOH,含有离子键、共价键,故答案为:离子键、共价键;
(5)K最外层1个电子,S最外层6个电子,则用电子式表示K2S的形成过程为

,
故答案为:
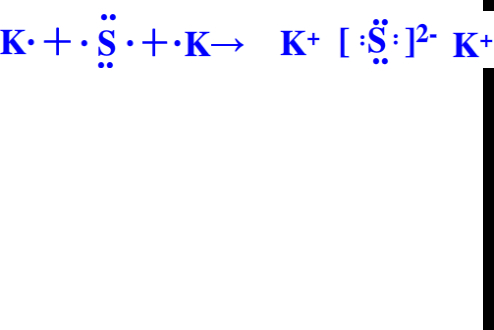
.
