问题
问答题
A、B、C、D 4种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C.
(1)B元素的名称______;B在周期表中的位置第______周期,______族;
(2)A、B形成的化合物的电子式______;
(3)C的最高价氧化物的化学式______;
(4)D的最高价氧化物对应的水化物的化学式______.
答案
A元素所处的周期数、主族序数、原子序数均相等,则A为H元素;
B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3,B的化合价为+5价,原子核外最外层电子数为5,则应为N元素;
C元素原子的最外层电子数比次外层少2个,核外各电子层电子数分别为2、8、6,应为S元素;
C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C,则D的最外层电子数为1,位于周期表第四周期,应为K元素,
(1)B为N元素,核外各层电子分别为2、5,应在元素周期表第二周期ⅤA族,故答案为:氮;二,第ⅤA族;
(2)A、B形成的化合物为NH3,为共价化合物,电子式为
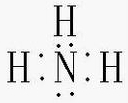
,故答案为:
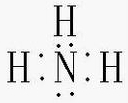
;
(3)C为S元素,S元素最外层电子数为6,则最高正化合价为+6价,则最高价氧化物的化学式为SO3,故答案为:SO3;
(4)D为K元素,其对应的最高价氧化物对应的水化物为KOH,故答案为:KOH.
