已知:A、B、C、D四种短周期元素,A与D的原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下转化关系,试推断回答下列问题.
(1)D元素原子的结构示意图为______;
(2)A、B、C三种元素的原子半径由小到大的顺序为______(用元素符号表示);
(3)Y与C元素的最高价氧化物可以发生反应,该反应的离子方程式为______;
(4)A与D两元素的气态氢化物之间可以反应生成一种盐,该盐的水溶液呈______(填“酸”、“碱”或“中”)性,该水溶液中各离子浓度由小到大的顺序为______(用具体离子符号表示);
(5)实验室中,应将X的浓溶液保存在棕色试剂瓶中,其原因是______(用化学方程式表示).
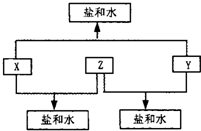
A、B、C、D四种短周期元素,A与D的原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,所以D是Cl元素;B、C、D三种元素位于同一周期,在反应中B、C最高价氧化物的水化物生成盐和水,所以B、C应该是第三周期的金属元素,也就是说B、C应该是钠镁铝之间的,又因为Y+Z=盐和水,X+Z=盐+水,所以Z是氢氧化铝,C是铝;氢氧化铝可以和强碱生成偏铝酸盐和水,所以B应该是钠,C是铝,A与D的原子序数之和等于B与C的原子序数之和,得出A是氮.
(1)D元素是氯元素,其原子结构示意图为
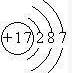
,故答案为:

;
(2)电子层数越多,原子的半径越大,电子层数相同的原子,原子半径随着原子序数的增大而减小,所以原子半径由小到大的顺序为N<Al<Na,
故答案为:N<Al<Na;
(3)Y是强碱,C的氧化物是氧化铝,氧化铝和强碱反应生成偏铝酸盐,离子方程式为:Al2O3+2OH-+3H2O=2[Al(OH)4]-,故答案为:Al2O3+2OH-+3H2O=2[Al(OH)4]-;
(4)A与D两元素的气态氢化物之间可以反应生成一种盐,该盐是氯化铵,氯化铵是强酸弱碱盐,能水解导致氢离子浓度大于氢氧根离子浓度,溶液呈酸性;铵根离子水解导致氯离子浓度大于铵根离子浓度,氢离子浓度大于氢氧根离子浓度,含有弱根离子的盐以电离为主水解为次,所以铵根离子浓度大于氢离子浓度,
故答案为:酸;c(OH-)<c(H+)<c(NH4+)<c(Cl-);
(5)X的浓溶液是浓硝酸,光照条件下,浓硝酸分解生成二氧化氮、氧气和水 4HNO3(浓)
4NO2↑+O2↑+2H2O,所以要避光保存, 光照 .
故答案为:4HNO3(浓)
4NO2↑+O2↑+2H2O. 光照 .
